
| A、N2 |
| B、HF |
| C、NH3 |
| D、CO2 |


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
| A、稀释溶液,水解程度减小 | ||||||
| B、通入CO2,平衡朝正反应方向移动 | ||||||
C、升高温度,
| ||||||
| D、加入NaOH固体,溶液PH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| B、某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| C、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色,将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
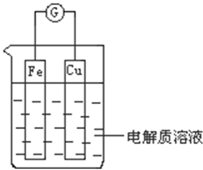 能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.84L |
| B、8.96L |
| C、15.68L |
| D、17.92L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
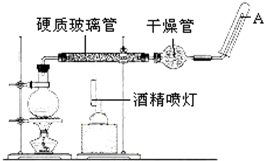 在高温下,Fe与水蒸气可发生反应.应用右边装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
在高温下,Fe与水蒸气可发生反应.应用右边装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com