
”¾ĢāÄæ”æ¼×“¼ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ,ĄūÓĆĆŗ»Æ¹¤ÖŠÉś²śµÄCOŗĶH2æÉÖĘČ”¼×“¼£¬·¢ÉśµÄ·“Ó¦ĪŖCO(g)+2H2(g) ![]() CH3OH(g) ”÷H=-99kJ/mol”£
CH3OH(g) ”÷H=-99kJ/mol”£
£Ø1£©¹ŲÓŚøĆ·“Ó¦µÄĻĀĮŠĖµ·Ø,“ķĪóµÄŹĒ___________”£
A.ĻūŗÄCOŗĶĻūŗÄCH3OHµÄĖŁĀŹĻąµČŹ±£¬ĖµĆ÷øĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬
B.ÉżøßĪĀ¶Č,Õż·“Ó¦ĖŁĀŹ¼õŠ”£¬Äę·“Ó¦ĖŁĀŹŌö“ó
C.Ź¹ÓĆ“ß»Æ¼Į£¬æÉŅŌĢįøßCOµÄ×Ŗ»ÆĀŹ
D.Ōö“óŃ¹Ē棬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż²»±ä
£Ø2£©ŌŚÄ³ĪĀ¶ČŹ±£¬½«1.0mol CO Óė2.0 mol H2³äČė2 LµÄæÕøÖĘæÖŠ,·¢ÉśÉĻŹö·“Ó¦,ŌŚµŚ5 minŹ±“ļµ½»ÆŃ§Ę½ŗāדĢ¬£¬“ĖŹ±¼×“¼µÄĪļÖŹµÄĮæ·ÖŹżĪŖ10%”£¼×“¼ÅØ¶ČµÄ±ä»ÆדæöČēĶ¼ĖłŹ¾:

¢Ł“Ó·“Ó¦æŖŹ¼µ½5 min Ź±£¬Éś³É¼×“¼µÄĘ½¾łĖŁĀŹĪŖ________”£
¢Ś5 min Ź±“ļµ½Ę½ŗā£¬H2µÄĘ½ŗā×Ŗ»ÆĀŹ¦Į=_____%.»ÆŃ§Ę½ŗā³£ŹżK= _______”£
¢Ū1min Ź±µÄvÕż(CH3OH)______ 4min Ź±vÄę(CH3OH ) £ØĢī”°“óÓŚ”°Š”ÓŚ”°»ņ”°µČÓŚ”±£©”£
¢ÜČō½«øÖĘæ»»³ÉĶ¬ČŻ»żµÄ¾ųČČøÖĘ棬ÖŲø“ÉĻŹöŹµŃé£¬Ę½ŗāŹ±¼×“¼µÄĪļÖŹµÄĮæ·ÖŹż_____0.1(Ģī”°>”±”°<”±»ņ”°=”±)
”¾“š°ø”æ B”¢C 0.025mol/(L”¤min) 25 0.59 “óÓŚ <
”¾½āĪö”æ£Ø1£©ĻūŗÄCOŗĶĻūŗÄCH3OHµÄĖŁĀŹĻąµČŹ±£¬ĖµĆ÷·“Ó¦µÄÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ĖłŅŌ·“Ó¦Ņ»¶Ø“ļĘ½ŗā£¬Ń”ĻīAÕżČ·”£ÉżøßĪĀ¶ČŅ»¶ØŹĒÕżÄę·“Ó¦ĖŁĀŹ¶¼¼Óæģ£¬ĖłŅŌŃ”ĻīB“ķĪ󔣓߻ƼĮ²»øıäĘ½ŗāĢ¬£¬Ņ²¾ĶŅ»¶Ø²»øıä×Ŗ»ÆĀŹ£¬Ń”ĻīC“ķĪ󔣻Æѧ·“Ó¦Ę½ŗā³£ŹżÖ»ÓėĪĀ¶ČÓŠ¹Ų£¬ĖłŅŌŌö“óŃ¹Ēæ£¬Ę½ŗā³£Źż²»±ä£¬Ń”ĻīDÕżČ·”£
£Ø2£©øł¾ŻĢāÄæŹż¾Ż¼ĘĖćČēĻĀ£ŗ
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
ĘšŹ¼£ŗ 0.5 1 0
·“Ó¦£ŗ X 2X X
Ę½ŗā£ŗ 0.5-X 1-2X X £ØŅŌÉĻµ„Ī»ĪŖmol/L£©
¼×“¼µÄĪļÖŹµÄĮæ·ÖŹżĪŖ10%£¬ĖłŅŌ![]() £¬X=0.125mol/L”£
£¬X=0.125mol/L”£
¢Ł¼×“¼µÄĖŁĀŹĪŖ0.125”Ā5=0.025 mol/(L”¤min)”£
¢ŚÓÉÉĻŹö¼ĘĖć£¬·“Ó¦µÄĒāĘųĪŖ2”Į0.125=0.25£¬×Ŗ»ÆĀŹĪŖ0.25”Ā1=25%”£“ļĘ½ŗāŹ±CO”¢H2ŗĶCH3OHµÄĪļÖŹµÄĮæÅØ¶Č·Ö±šĪŖ£ŗ0.375mol/L”¢0.75mol/LŗĶ0.125mol/L£¬ĖłŅŌĘ½ŗā³£ŹżK£½0.125/0.375”Į0.752£½0.59”£
¢Ū·“Ó¦“ļĘ½ŗāµÄĖŁĀŹĶ¼ĻńČēĻĀĶ¼£ŗ
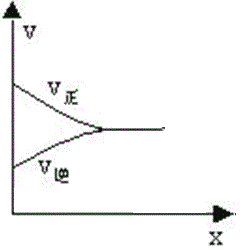
ĖłŅŌ£¬ŌŚ“ļĘ½ŗāĒ°ČĪŅāµćµÄÕż·“Ó¦ĖŁĀŹ“óÓŚČĪŅāµćµÄÄę·“Ó¦ĖŁĀŹ£¬¼“1minŹ±µÄvÕż(CH3OH)£¾4minŹ±vÄę(CH3OH)”£
¢ÜČō½«øÖĘæ»»³ÉĶ¬ČŻ»żµÄ¾ųČČøÖĘ棬ÖŲø“ÉĻŹöŹµŃ飬Ōņ·“Ó¦·Å³öµÄČČĮæ²»ÄÜÉ¢·¢£¬»įŹ¹ĢåĻµĪĀ¶ČÉĻÉż£¬Õż·“Ó¦·ÅČČ£¬ĪĀ¶ČÉżøߣ¬Ę½ŗāÄęĻņŅĘ¶Æ£¬¼×“¼Ģå»ż·ÖŹż½«¼õŠ”£¬ĖłŅŌŠ”ÓŚ0.1”£


 ĆæČÕ10·ÖÖÓæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
ĆæČÕ10·ÖÖÓæŚĖćŠÄĖćĖŁĖćĢģĢģĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµ±Ņ»æ鱳Ȍ»Æ³ÉĖ®£¬ŌŁ×Ŗ±äĪŖĖ®ÕōĘųŹ±£¬Ņ»¶Ø£Ø £©
A.ĻČ·Å³öÄÜĮ棬ŌŁĪüŹÕÄÜĮæB.ĻČĪüŹÕÄÜĮ棬ŌŁ·Å³öÄÜĮæ
C.Ö»·Å³öÄÜĮæD.Ö»ĪüŹÕÄÜĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗŪ¼ģŹĒ¹«°²»ś¹ŲĢįČ”·ø×ļĻÓŅÉČĖÖøĪʵÄŅ»ÖÖÖŲŅŖµÄ·½·Ø£¬AgNO3ĻŌĻַؾĶŹĒĘäÖŠŅ»ÖÖ£ŗČĖµÄŹÖÉĻÓŠŗ¹×Õ£¬ÓĆŹÖ¶Æ¹ż°×Ö½ŗó£¬ŹÖÖøĪĘĻß¾ĶĮōŌŚÖ½ÉĻ”£Čē¹ū½«ČÜŅŗ¢ŁŠ”ŠÄĶæµ½Ö½ÉĻ£¬ČÜŅŗ¢ŁÖŠµÄČÜÖŹ¾Ķøśŗ¹×ÕÖŠµÄĪļÖŹ¢Ś×÷ÓĆ£¬Éś³ÉĪļÖŹ¢Ū£¬ĪļÖŹ¢ŪŌŚ¹āÕÕĻĀ£¬·Ö½ā³öµÄŅųĮ£³Ź»ŅŗÖÉ«£¬Ėę×Å·“Ó¦µÄ½ųŠŠ£¬ŅųĮ£Öš½„Ōö¶ą£¬ÓÉ×ŲÉ«±ä³ÉŗŚÉ«µÄÖøĪĘĻß”£ÓĆĻĀĮŠ»ÆѧŹ½±ķŹ¾ÕāČżÖÖĪļÖŹ¶¼ÕżČ·µÄŹĒ (”” )
A£®¢ŁAgNO3£»¢ŚNaBr£»¢ŪAgBr B£®¢ŁAgNO3£»¢ŚNaCl£»¢ŪAgCl
C£®¢ŁAgCl£» ¢ŚAgNO3£»¢ŪNaCl D£®¢ŁAgNO3£»¢ŚNaCl£»¢ŪAg
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲÄÜŌ“ÓėÄÜĮæµÄĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
A.ĆŗŗĶŹÆÓĶŹĒ¾¹żŅŚĶņÄźŠĪ³ÉµÄ£¬ŅŚĶņÄźŗóĆŗŗĶŹÆÓĶ»¹»įÉś³É£¬¹Ź¶žÕߏōæÉŌŁÉśÄÜŌ“
B.ÕōĘūŹōÓŚŅ»“ĪÄÜŌ“
C.·²¾¹ż¼ÓČȶų·¢ÉśµÄ·“Ó¦¶¼ŹĒĪüČČ·“Ó¦£¬³£ĪĀĻĀ½ųŠŠµÄ·“Ó¦¶¼ŹĒ·ÅČČ·“Ó¦
D.·“Ó¦ĪļŗĶÉś³ÉĪļµÄ×ÜÄÜĮæ¾ö¶Ø·“Ó¦ŹĒ·ÅČČ»¹ŹĒĪüČČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČ«·°ŅŗĮ÷µē³Ų£¬¼ņ³Ę·°µē³Ų£¬ĖüµÄµēÄÜŹĒŅŌ»ÆѧÄܵķ½Ź½“ę“¢ŌŚ²»Ķ¬¼ŪĢ¬·°Ąė×ÓµÄĮņĖįµē½āŅŗÖŠ£¬²ÉÓĆÖŹ×Ó½»»»Ä¤×÷ĪŖµē³Ų×éµÄøōĤ£¬µē½āÖŹČÜŅŗĘ½ŠŠĮ÷¹żµē¼«±ķĆę²¢·¢Éśµē»Æѧ·“Ó¦”£µē³Ų×Ü·“Ó¦ĪŖVO2++V3++H2O![]() V2++VO2++2H+”£ĻĀĶ¼ŹĒ·°µē³Ų»ł±¾¹¤×÷ŌĄķŹ¾ŅāĶ¼”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
V2++VO2++2H+”£ĻĀĶ¼ŹĒ·°µē³Ų»ł±¾¹¤×÷ŌĄķŹ¾ŅāĶ¼”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ

A. µē³ŲĶźČ«·Åµēŗó£¬Õż”¢øŗ¼«·Ö±šĪŖVO2+ŗĶV3+Ąė×ÓČÜŅŗ
B. ·ÅµēŹ±£¬øŗ¼«·“Ó¦Ź½ĪŖV2+-e-=V3+
C. ³äµē¹ż³ĢÖŠ£¬øŗ¼«µē½āŅŗµÄpH²»±ä
D. ³äµēŹ±£¬Ńō¼«·“Ó¦Ź½ĪŖVO2++H2O-e-=VO2++2H+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°Ē§Äź“ó¼Ę”¢¹ś¼Ņ“óŹĀ”±£¬ŠŪ°²ŠĀĒųĪŽŅÉŹĒ½ńÄź×īŹÜÖõÄæµÄµŲĒų”£²»¹ż£¬½üČÕĆ½Ģå±ØµĄŗÓ±±ĄČ·»”¢Ģģ½ņµČµŲ“ęŌŚ³¬“ó¹ęÄ£µÄ¹¤ŅµĪŪĖ®ÉųæÓ£¬øųŠŪ°²ŠĀĒųµÄĖ®»·¾³“ųĄ“Ņž»¼£¬ÄæĒ°Õż²ÉÓƶąÖÖ·½·Ø¶ŌĪŪĖ®½ųŠŠ“¦Ąķ£¬øÄÉĘĖ®×ŹŌ“דæö”£
£Ø1£©ŌŚĪ¢ÉśĪļ×÷ÓƵÄĢõ¼žĻĀ,·ĻĖ®ÖŠµÄNH4+¾¹żĮ½²½·“Ó¦Ńõ»Æ³ÉNO3-£¬Į½²½·“Ó¦µÄÄÜĮæ±ä»ÆŹ¾ŅāĶ¼ČēĻĀ:
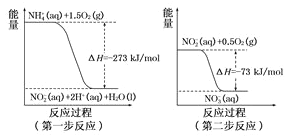
¢ŁµŚŅ»²½·“Ó¦ŹĒ______·“Ó¦(Ń”Ģī”°·ÅČČ”±»ņ”°ĪüČČ”±)£¬ÅŠŠĀŅĄ¾ŻŹĒ_________”£1mol NH4+ (aq)Č«²æŃõ»Æ³ÉNO3- (aq)µÄČČ»Æѧ·½³ĢŹ½ĪŖ_____________”£
¢ŚŅ»¶ØĢõ¼žĻĀ,Ļņ·ĻĖ®ÖŠ¼ÓČėCH3OH,½«HNO3»¹Ō³ÉN2”£ČōøĆ¹ż³ĢÖŠCH3OH·“Ӧɜ³ÉCO2,Ōņ²Ī¼Ó·“Ó¦µÄ»¹Ō¼ĮŗĶŃõ»Æ¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ______.
£Ø2£©¶žŃõ»ÆĀČ(ClO2)ŹĒŅ»ÖÖ»ĘĀĢÉ«µ½³Č»ĘÉ«µÄĘųĢ壬ŹĒ¹ś¼ŹÉĻ¹«ČĻĪŖ°²Č«”¢ĪŽ¶¾µÄĀĢÉ«Ļū¶¾¼Į,æÉŅŌĶ¶Čė·ĻĖ®ÖŠĒå³żĪŪČ¾Īļ”£
¢Ł¶žŃõ»ÆĀČæÉŅŌ½«·ĻĖ®ÖŠµÄĒč»ÆĪļ(CN-)Ńõ»Æ³ÉĮ½ÖÖĪŽĪŪČ¾ĘųĢå.Š“³öĄė×Ó·½³ĢŹ½________”£
¢Ś·ĻĖ®ÖŠµÄÖŲ½šŹōĄė×ÓµÄĪ£ŗ¦ŠŌŗܓ󣬶žŃõ»ÆĀČÄܹ»ŌŚČõĖįŠŌČÜŅŗÖŠ°Ń¶ž¼ŪĆĢĄė×ÓŃõ»Æ³É²»ČÜÓŚĖ®µÄ¶žŃõ»ÆĆĢ(MnO2)£¬Š“³ö·“Ó¦µÄĄė×Ó·½³ĢŹ½_______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĀČ»ÆÄĘ”¢äå»ÆÄĘŗĶµā»ÆÄʵĻģŗĻČÜŅŗÖŠĶØČėŅ»¶ØĮæµÄĀČĘų£¬ČōČÜŅŗÖŠŗ¬ÓŠBr2£¬ŌņČÜŅŗÖŠŅ»¶Ø²»ŗ¬ÓŠ
A.Cl2B.I-C.Cl-D.Br-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Ę¼Ųļ§Ģś·Æ[KNH4Fex(SO4)y(OH)z] ²»ČÜÓŚĖ®ŗĶĻ”ĮņĖį£¬ÖĘČ”Į÷³ĢČēĻĀ£ŗ

Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ČÜŅŗXŹĒ_______”£
£Ø2£©ŌŚ»Ę¼Ųļ§Ģś·Æ[KNH4Fex(SO4)y(OH)z] ÖŠ£¬x”¢y”¢zµÄ“śŹż¹ŲĻµŹ½ĪŖ_______”£
£Ø3£©¼ģŃéĀĖŅŗÖŠŹĒ·ń“ę ŌŚK+µÄ²Ł×÷ŹĒ_______”£
£Ø4£©»Ę¼Ųļ§Ģś·ÆµÄ»ÆѧŹ½æÉĶعżĻĀĮŠŹµŃé²ā¶Ø£ŗ
²½Öč1£ŗ ³ĘČ”Ņ»¶ØÖŹĮæµÄѳʷ¼ÓČėĻ”ĻõĖį³ä·ÖČܽā£¬½«ĖłµĆČÜŅŗ×ŖŅĘÖĮČŻĮæĘæÅäÖĘ³É100.00mL ČÜŅŗA”£
²½Öč2£ŗ ×īČ”25.00mLČÜŅŗA,¼ÓČėŃĪĖįĖį»ÆµÄBaCl2ČÜŅŗÖĮ³ĮµķĶźČ«,¹żĀĖ”¢Ļ“µÓ”¢øÉŌļÖĮŗćÖŲ£¬µĆµ½°×É«¹ĢĢå9.32g”£
²½Öč3£ŗ ĮæČ”25.00mLČÜŅŗA,¼ÓČė×ć×īNaOHČÜŅŗ£¬¼ÓČČ£¬ŹÕ¼Æµ½±ź×¼×“ĻĀĘųĢå224mL,Ķ¬Ź±ÓŠŗģŗÖÉ«³ĮµķÉś³É”£
²½Öč4£ŗ ½«²½Öč3ĖłµĆ³Įµķ¹żĀĖ”¢Ļ“µÓ”¢×ĘÉÕ£¬×īÖÕµĆ¹ĢĢå4.80g”£
¢Ł²½Öč1ÅäÖĘČÜŅŗAĖłŠčµÄ²£Į§ŅĒĘ÷³żÉÕ±”¢²£Į§°ō”¢½ŗĶ·µĪ¹ÜĶā,»¹Šč_______”£
¢Śøł¾ŻŅŌÉĻŹµŃ鏿¾Ż¼ĘĖć»Ę¼Ųļ§Ģś·ÆÖŠµÄn(OH-)”Ćn(SO42-)µÄ±ČÖµĪŖ_______”£(Š“³ö±ŲŅŖµÄ¼ĘĖć¹ż³Ģ£¬·ńŌņ²»µĆ·Ö)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®“¦Ąķ¼¼ŹõŌŚÉś²ś”¢Éś»īÖŠÓ¦ÓĆ¹ć·ŗ£¬¶Ō¹¤Ņµ·ĻĖ®ŗĶÉś»īĪŪĖ®½ųŠŠ“¦ĄķŹĒ·ĄÖ¹Ė®ĢåĪŪČ¾”¢øÄÉĘĖ®ÖŹµÄÖ÷ŅŖ“ėŹ©£®
£Ø1£©Ė®µÄ¾»»ÆŗĶČķ»ÆµÄĒų±šŹĒĖ®µÄ¾»»ÆŹĒÓĆ»ģÄż¼Į½«Ė®ÖŠµÄ½ŗĢå¼°Šüø”Īļ³ĮµķĻĀĄ“£¬¶ųĖ®µÄČķ»ÆŹĒ£»
£Ø2£©Éś»īÓĆĖ®±ŲŠė±£Ö¤°²Č«£¬×ŌĄ“Ė®³§ŠčŅŖ¶ŌČ”×Ō½ŗÓŗž²“ÖŠµÄµĖ®½ųŠŠÉ±¾śĻū¶¾”¢»ģÄż³Įµķ”¢¹żĀĖµČ¹¤ŅÕ“¦Ąķ£¬ÕāČżĻī“¦ĄķµÄÕżČ·Ė³ŠņŹĒ£»
£Ø3£©ĻĀĮŠŹŌ¼ĮÄܹ»ÓĆĄ“¶Ō×ŌĄ“Ė®½ųŠŠÉ±¾śĻū¶¾£¬ĒŅ²»»įŌģ³É¶ž“ĪĪŪČ¾µÄŹĒ£ØĢī×ÖÄø£©£®
a£®ø£¶ūĀķĮÖ b£®ĘÆ°×·Ū c£®ĀČĘų d£®³ōŃõ
£Ø4£©Na2FeO4ŹĒŅ»ÖÖŠĀŠĶĖ®“¦Ąķ¼Į£¬¹¤ŅµÉĻæÉÓĆFeSO4ÖʱøNa2FeO4Ę乤ŅÕĮ÷³ĢČēĻĀ£ŗ ![]()
¢Ł¹¤ŅµÉĻ³£ÓĆĮņĖįŃĒĢś×÷»ģÄż¼Į³żČ„ĢģČ»Ė®ÖŠŗ¬ÓŠµÄŠüø”ĪļŗĶ½ŗĢ壬ĪŖĮĖ“ļµ½øüŗƵĊ§¹ū£¬ŅŖ½«“ż“¦ĄķĖ®µÄpHµ÷µ½9×óÓŅ£¬ŌŁ¼ÓČėĀĢ·Æ£®Ēė½āŹĶÕāŅ»×ö·ØµÄŌŅņ£ØÓƱŲŅŖµÄĄė×Ó·½³ĢŹ½ŗĶĪÄ×ÖĆčŹö£©£®
¢ŚŠ“³öÓÉFe£Ø0H£©3ÖĘČ”Na2FeO4µÄ»Æѧ·½³ĢŹ½£»
£Ø5£©ŹÆ»Ņ“æ¼ī·ØŹĒ³£ÓƵÄÓ²Ė®Čķ»Æ·½·Ø£¬ŅŃÖŖ25”ꏱKsp£ØCaCO3£©=2.8”Į10©9 £¬ ĻÖ½«µČĢå»żµÄCa£ØOH£©2ČÜŅŗÓėNa2CO3ČÜŅŗ»ģŗĻ£Ø¼ŁÉčČÜŅŗĢå»ż¾ßÓŠ¼ÓŗĶŠŌ£©£¬ČōNa2CO3ČÜŅŗµÄÅضČĪŖ5.6”Į10©5molL©1 £¬ ŌņÉś³É³ĮµķĖłŠčCa£Ø0H£©2ČÜŅŗµÄ×īŠ”ÅضČĪŖ £®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com