
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是
A.X的氢化物溶于水生成弱酸
B.Z的氢化物的水溶液在空气中存放不易变质
C.Y与X可生成Y3X2型化合物
D.Z的单质在氧气中燃烧可以生成两种酸性氧化物
【知识点】原子结构与元素周期率的关系 E1 E2
【答案解析】C 解析: 短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,则X的内层电子数为2,Z的最外层电子数为6,Y的最外层电子数为2,原子的最外层电子数之和为13,则X的最外层电子数为13-6-2=5,所以X为N,Y为Mg,Z为S。
A.N的氢化物为氨气,溶于水显碱性,故A错误;B.Z的氢化物为硫化氢,硫元素的化合价为最低价,具有较强的还原性,其水溶液在空气中存放易被氧化,故B错误;C.Mg与N可生成Mg3N2型化合物,故C正确; D.Z为S,在氧气中燃烧只生成二氧化硫一种氧化物,故D错误.
【思路点拨】本题考查了学生利用元素的位置及原子的最外层电子数和内层电子数的关系来推断元素,利用X为第二周期元素为突破口是解答本题的关键,利用元素化合物知识来解答此类习题。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
右图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要
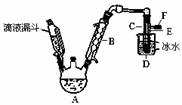 加热,图中省去了加热装置。有关数据见表:
加热,图中省去了加热装置。有关数据见表:
表.乙醇、溴乙烷、溴有关参数
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
⑴ 制备操作中,加入的浓硫酸必需进行稀释,其目的是 (选填序号)。
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.减少HBr的挥发d.水是反应的催化剂
⑵ 已知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应
的化学方程式 。
⑶ 仪器B的名称 ,冷却水应从B的 (填“上”或“下”)口流进。
⑷ 反应生成的溴乙烷应在 中(填“A”或“C”中)。
⑸ 若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列 (选填序号)
溶液来洗涤产品。
a.氢氧化钠 b.亚硫酸钠 c.碘化亚铁 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
.某学习兴趣小组讨论辨析以下说法,其中说法正确的是( )
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物
A.③⑤⑥ B.①② C.③⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质的性质比较中,正确的是
A.酸性:HClO4>H3PO4>H2SO4 B.氢化物的稳定性:H2S>HF>H2O
C.碱性:Al(OH)3>Mg(OH)2>NaOH D.氧化性:F2>C12>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式) ;E、F、L、I所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式 。
(3)在10 L的密闭容器中,通入2 mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 KJ的热量,则平衡时LD2的转化率为 ;该反应的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的化学用语表达正确的是( )
A.甲烷的球棍模型:
B.(CH3)3COH的名称:2,2二甲基乙醇
C.乙醛的结构式:CH3CHO
D.羟基的电子式: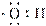
查看答案和解析>>
科目:高中化学 来源: 题型:
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,凡含有手性碳原子的物质一定具有光学活性,如物质
 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )
①与甲酸发生酯化反应 ②与NaOH溶液反应 ③与银氨溶液作用 ④在催化剂存在下与氢气作用
A.①③ B.②④ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是传统的工业生产金属铝的基本流程图,结合铝生产的流程图解答下列各题:
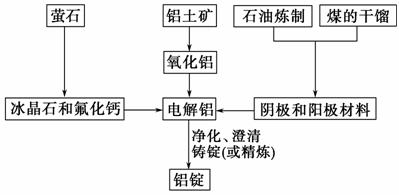
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是__________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2 050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是_________________________________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是: ______________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解熔融MgCl2,电解反应方程式为____________________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com