
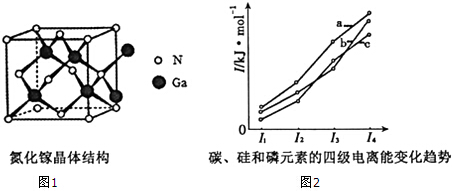
分析 (1)Ge是32号元素,其原子核外有32个电子,根据构造原理书写其基态原子核外电子排布式;
(2)A.分子晶体的熔、沸点低;
B.不同非金属元素之间形成极性共价键;
C.根据只有和电负性大的元素(如O,N,F等)相连的H与电负性大的元素(如O,N,F等)相连才能形成氢键;
D.稀有气体的稳定结构:只有1个电子层,有2个电子或最外层为8电子结构;
(3)Ga的最外层电子数为3,而氮化稼(GaN)的晶体中1个Ga原子可以和4个N形成共价键,即Ga形成4条共价键;
(4)根据杂化轨道数=σ键数目+孤对电子对数,确定杂化类型;根据1个单键是1个σ键,一个双键含有1个σ键和1个π键,一个三键含有1个σ键和2个π键;
(5)利用第一电离能大小判断,同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅤA族的大于第ⅥA族的;
解答 解:(1)Ge是32号元素,其原子核外有32个电子,根据构造原理知其基态原子核外电子排布式为1s22s22p63s23p63d104s24p2;
故答案为:1s22s22p63s23p63d104s24p2;
(2)丙烯腈分子CH2=CH-CN中双键上的碳原子形成3个σ键,无孤电子对,sp2杂化,与氮相连的碳原子形成2个σ键,无孤电子对,sp杂化;丙烯腈(CH2=CH-C≡N)分子中含有6个σ键和3个π键,数目之比为 2:1;
故答案为:sp2杂化、sp杂化;2:1;
(3)A.(CH3)3Ga在常温常压下均为无色透明的液体,熔点低,属于分子晶体,故A正确;
B.(CH3)3Ga中所含化学键为碳氢键、碳稼键,都属于极性键,故B正确;
C.(CH3CH2)3Ga晶体中没有电负性大的原子,不能形成氢键,故C错误;
D.(CH3CH2)3Ga中Ga原子最外层只有6个电子,未达到稀有气体的稳定结构,故D错误;
故选:AB.
(4)Ga的最外层电子数为3,而氮化稼(GaN)的晶体中1个Ga原子可以和4个N形成共价键,即Ga形成4条共价键,所以Ga原子提供1个空轨道,N原子提供孤电子对,形成配位键;
故答案为:有;氮化稼(GaN)的晶体中1个Ga原子可以和4个N形成共价键,而Ga的最外层电子数为3,所以Ga原子提供1个空轨道,N原子提供孤电子对,形成配位键;
(5)同一主族元素的第一电离能随着原子序数的增大而减小,同一周期元素的第一电离能随着原子序数的增大而增大,第ⅤA族的大于第ⅥA族的,碳第一电离能大于磷,所以碳、硅和磷的第一电离能:碳>磷>硅,故选b.
点评 本题考查电子排布式、化学键的分类与判断、原子的杂化、第一电离能以及有关晶体的性质,难度不大,要求学生对基础知识能够熟练掌握.


科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
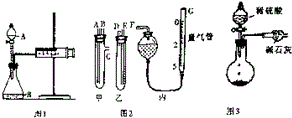 某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.
某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案-气体分析法.| 样品号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸溶液的体积/mL | 30 | 30 | 30 | 30 |
| 样品质量/g | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积/mL | 672 | 840 | 896 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化工生产中应遵循“绿色化学”的思想 | |
| B. | 通常用来衡量一个国家的石油化学工业发展水平的标志是乙烯的产量 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{17}$O原子核内有9个质子 | B. | H原子核内有1个中子 | ||
| C. | O2和O3互为同位素 | D. | 32He和42He是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
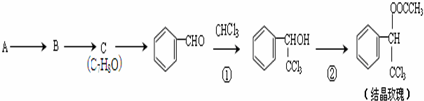
 .
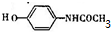
.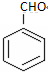 的核磁共振氢谱图中有4组峰.
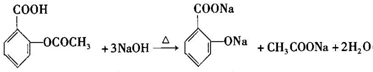
的核磁共振氢谱图中有4组峰.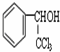 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$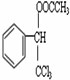 +H2O.
+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com