
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下:
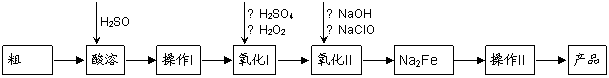 |
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
① Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
请描述随温度变化规律:温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,____________________________________________________。NaClO浓度随温度变化具有上述规律的原因为:____________________________________________________
科目:高中化学 来源: 题型:
化合物D是硅橡胶的稳定剂,其合成路线如下图

(1)B的分子式为 ▲ ; C中官能团名称 ▲ 。
(2)C→D的反应类型为 ▲ 。
(3)B→C的化学方程式为 ▲ 。
(4)化合物D可能具有的性质有 ▲ (选填序号)。
a.与FeCl3溶液发生显色反应 b.加成反应 c.消去反应 d.酯化反应
(5)化合物B经3步反应可制备 ,反应类型依次是 ▲ (选填序号)。
,反应类型依次是 ▲ (选填序号)。
a.加成 、 取代、 消去 b.消去、加成、取代 c.取代、消去、加成
(6)写出同时满足下列条件的A的一种同分异构体的结构简式 ▲ 。
①核磁共振氢谱只有一个峰 ②分子中没有碳碳双键也无环状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是反应2A + 3B = C + 4D在不同时刻测得的速率,其中最快的是
A.V(A)=0.6mol/L.s B.V(B)=0.9mol/L.s
C.V(C)=0.4mol/L.s D.V(D)=1.0mol/L.s
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是可逆反应X2 + 3Y2  2Z2 在反应
2Z2 在反应
过程中的反应速率V与时间(t)的关系曲线,
下列叙述正确的是
A.t1时,只有正方向反应
B.t2时,反应到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
通式为CnH2n-2的一种气态烃完全燃烧后生成CO2和H2O的物质的量之比为4:3,这种烃的链状同分异构体有( )
A.2种 B.3种 C.4种 D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家最近在-100 ℃的低温下合成一种烃X,此分子的模型如右图(图中的连线表示化学键),下列说法正确的是( )
 A.X能使溴的四氯化碳溶液褪色
A.X能使溴的四氯化碳溶液褪色
B.X是一种在常温下能稳定存在的液态烃
C.X分子中在同一平面上的碳原子最多有5个
D.充分燃烧等质量的X和甲烷,X消耗氧气多
查看答案和解析>>
科目:高中化学 来源: 题型:
镁电池毒性低、污染小,电压高而平稳,它逐渐成为人们研制绿色电池的关注焦点。其中一种镁电池的反应原理为: 下列说法不正确的是
A.放电时,正极反应式:Mo3S4+2xe- =Mo3S42x-
B.放电时,Mo3S4发生氧化反应
C.充电时,Mg2+向阴极迁移
D.充电时,阴极反应式:xMg2++2xe-=xMg
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有3个电子。
(1)C原子的基态电子排布式为__________;若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式分类,A与C形成的最简单化合物中的共价键属于__________键。
(2)当n=2时,元素A在周期表中的位置是__________,B与C形成的化合物的VSEPR模型名称为__________形。
(3)当n=3时,B与C形成的晶体类型是__________,此时A、B、C、D四种元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com