
【题目】常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.pH=8的CH3COONa溶液:c(CH3COOH)=9.9×10-7 mol·L-1
B.0.1 mol·L-1Na2SO3溶液:c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.0.1 mol·L-1NaHCO3溶液:c(Na+)+c(OH-)=c(HCO3-)+c(H2CO3)+c(H+)
D.0.1 mol·L-1CH3COONa溶液中通入HCl至溶液pH=7:c(Na+)>c(CH3COOH)>c(Cl-)
【答案】A
【解析】
A、CH3COO-+H2O![]() CH3COOH+OH-,H2O
CH3COOH+OH-,H2O![]() H++OH-,由方程式可知,溶液中的OH-来自CH3COO-的水解,以及H2O的电离。常温下pH=8,溶液中c(OH-)=10-6 mol·L-1,溶液c(H+)均由水电离得到,溶液中的OH-,来自与水的电离的浓度为10-8,则溶液中的由水解得到的c(OH-)=10-6-10-8 mol·L-1,根据水解方程式,可知CH3COOH的浓度与水解得到OH-的浓度相同,则c(CH3COOH)= 10-6-10-8 mol·L-1=9.9×10-7 mol·L-1,A正确;
H++OH-,由方程式可知,溶液中的OH-来自CH3COO-的水解,以及H2O的电离。常温下pH=8,溶液中c(OH-)=10-6 mol·L-1,溶液c(H+)均由水电离得到,溶液中的OH-,来自与水的电离的浓度为10-8,则溶液中的由水解得到的c(OH-)=10-6-10-8 mol·L-1,根据水解方程式,可知CH3COOH的浓度与水解得到OH-的浓度相同,则c(CH3COOH)= 10-6-10-8 mol·L-1=9.9×10-7 mol·L-1,A正确;
B、0.1 mol·L-1Na2SO3溶液,有电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),B错误;
C、0.1 mol·L-1NaHCO3溶液中有,电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),物料守恒,c(Na+)= c(HCO3-)+c(H2CO3)+ c(CO32-);将两式中CO32-消去,得c(Na+)+c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),C错误;
D、在所得溶液中,有电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),pH=7,c(H+)=c(OH-),则c(Na+) =c(CH3COO-)+c(Cl-),c(Na+)> c(Cl-),关于CH3COONa有物料守恒,有c(Na+) =c(CH3COO-)+c(CH3COOH),结合c(Na+) =c(CH3COO-)+c(Cl-),则c(CH3COOH)= c(Cl-),正确排序应为c(Na+)>c(CH3COOH)=c(Cl-),D错误;
答案选A。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )

A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
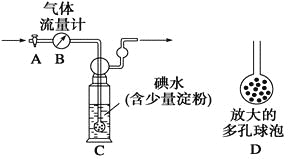
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_______________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:

(3)步骤①中过量H2O2的作用是________________________________________
(4)写出步骤②中反应的化学方程式_______________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是________________________________
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为__________________________(用含有V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过比较最高价氧化物对应的水化物的酸性强弱来验证碳与硅的非金属性强弱,他采用了如图所示的装置进行实验。请回答下列问题:

(1)仪器B的名称是______,应盛放下列药品中的______(填序号)。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.亚硫酸钠
(2)仪器A的名称是______,应盛放下列药品中的______(填序号)。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.稀盐酸
(3)仪器C中应盛放的药品是______,若看到______(填实验现象),即可证明______的酸性比______强,______的非金属性比______强。
(4)B中发生反应的离子方程式为____________________,C中发生反应的离子方程式为_______________。
(5)另一同学认为此实验尚有不足之处,你认为不足之处是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,完成下列问题。
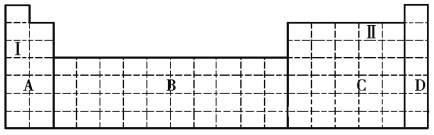
(1)在元素周期表中全部是金属元素的区域为______(填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为______、______,它们都是____________(填“共价化合物”或“离子化合物”)。
(3)现有甲、乙两种元素,在火山口和火山附近的温泉中有甲元素的单质出现,乙元素是唯一一种原子序数比甲元素大的短周期主族元素。
①将甲、乙两元素的元素符号填写在上面元素周期表中对应的位置。______
②甲、乙两元素中,非金属性较强的是______(填元素名称),可以验证该结论的实验现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列 化学反应不符合绿色化学概念的是( )
A. 消除硫酸厂尾气排放:SO2+2NH3+H2O=(NH4)2SO3
B. 消除制硝酸厂的氮氧化物污染:NO2+NO+2NaOH=2NaNO2+H2O
C. 制 CuSO4:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制 CuSO4:2Cu+O2![]() 2CuO,CuO+H2SO4(稀)=CuSO4+H2O
2CuO,CuO+H2SO4(稀)=CuSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。请回答下列问题:
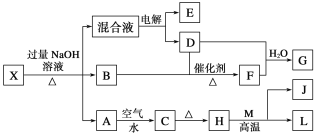
(1)B的电子式为____________。
(2)电解混合液时阳极反应式为_______________________。
(3)写出L长期放置在潮湿空气中的腐蚀原理:
负极:___________________________________。
正极:___________________________________。
总反应:______________________________________________________。
(4)已知a g E气体在D中完全燃烧生成稳定的化合物时,放出b kJ的热量,写出E气体燃烧热的热化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可以用于制取漂白剂和自来水杀菌消毒。常温下,溶液中Cl2(aq)、HClO和ClO-物质的量分数(α)随pH变化的关系如图所示。
已知,Cl2(g)![]() Cl2(aq)K1=10-1.2
Cl2(aq)K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl-K2=10-3.4
HClO+H++Cl-K2=10-3.4
下列说法正确的是

A.Cl2(g)+H2O![]() 2H++ClO-+Cl-K3=10-10.9
2H++ClO-+Cl-K3=10-10.9
B.氯气通入水中,c(HClO)+c(ClO-)<c(H+)-c(OH-)
C.pH=7.0时漂白能力要比pH=6.0时要强
D.氯气处理自来水时,在夏天的杀菌消毒效果要比在冬天好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com