
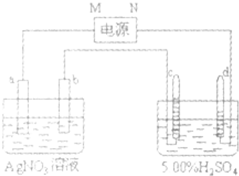
 图中电极a、b分别为Ag电极和Pt电傲,电极c、d都是石墨电极.通电一段时间后,在c、d两极共收集到336mL(标准状况)气体,其体积比为1:2.回答:
图中电极a、b分别为Ag电极和Pt电傲,电极c、d都是石墨电极.通电一段时间后,在c、d两极共收集到336mL(标准状况)气体,其体积比为1:2.回答:| 2 |
| 3 |
| ||


科目:高中化学 来源: 题型:
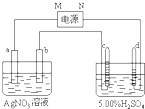 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,只在c、d两极上共收集到336mL(标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,只在c、d两极上共收集到336mL(标准状态)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
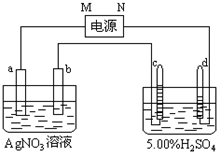 图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.回答:
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
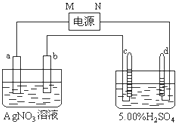 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,b电极变粗,且在c、d电极有气体产生,两极上共收集到336mL(标准状态)气体.回答:
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,b电极变粗,且在c、d电极有气体产生,两极上共收集到336mL(标准状态)气体.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)图中电极a、b分别为Ag电极和Pt电傲,电极c、d都是石墨电极。通电一段时间后,在c、d两极共收集到336mi。(标准状况)气体,其体积比为l:2。回答:
(1)直流电源中,M为 极。
(2)b电极上的电极反应方程式 ,c电极上的电极反应方程式 。
(3)通电一段时间,AgNO3溶液的pH(填”增大”、”减小”或”不变”。) 。
(4)若通电一段时间后H2SO4溶液的质撮分数由5.00%变为5.02%,则原5.00%,的H2SO4溶液为 g。(保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com