
����Ŀ����12�֣�SCR��NSR��������Ч���Ͳ��ͷ������ڿ������������µ�NOx�ŷš�
��1��SCR��ѡ���Դ���ԭ������ԭ���� 
������[CO(NH2)2]ˮ��Һ�ȷֽ�ΪNH3��CO2 �� �÷�Ӧ�Ļ�ѧ����ʽ����
�ڷ�Ӧ����NH3��ԭCO2�Ļ�ѧ����ʽ����
�۵�ȼ���к������ϸ�ʱ��β����SO2��O2�����»��γ�(NH4)2SO4 �� ʹ�����ж����û�ѧ����ʽ��ʾ(NH4)2SO4���γɣ���
��������ҺŨ��Ӱ��NO2��ת�����ⶨ��Һ�����أ�M=60 mg��L1�������ķ������£�ȡa g������Һ������������ȫת��ΪNH3 �� ����NH3�ù�����v1 mL c1 mol��L1 H2SO4��Һ������ȫ��ʣ��H2SO4��v2 mL c2 mol��L1 NaOH��Һǡ���кͣ���������Һ�����ʵ�������������
��2��NSR��NOx���滹ԭ������ԭ���� NOx�Ĵ���ͻ�ԭ�ڲ�ͬʱ�ν�����У���ͼa��ʾ��
��ͨ��BaO��Ba(NO3)2���ת��ʵ��NOx�Ĵ���ͻ�ԭ������NOx����������
����H2ģ��β���л�ԭ�������о���Ba(NO3)2�Ĵ���ԭ���̣��ù��̷��������У�ͼb��ʾ�ù����������Ũ����ʱ��ı仯��ϵ����һ����Ӧ���ĵ�H2��Ba(NO3)2�����ʵ���֮������
�ۻ�ԭ�����У���ʱ�����Ц����N2O������ͬλ��ʾ�ٷ��о�����Ц���IJ�����NO�йء�������������15NO��NH3��һ��������Ӧʱ���õ���Ц����������15NNO�����÷�Ӧ�Ļ�ѧ����ʽ����������  ��15NNO+��H2O
��15NNO+��H2O
���𰸡�
��1��CO(NH2)2+H2O ![]() 2NH3��+CO2����8NH3+6NO2
2NH3��+CO2����8NH3+6NO2![]() 7N2+12H2O��2SO2+O2+4NH3+2H2O==2(NH4)2SO4��
7N2+12H2O��2SO2+O2+4NH3+2H2O==2(NH4)2SO4��![]()
��2��BaO��8��1��415NO+4NH3+3O2![]() 415NNO+6H2O
415NNO+6H2O
����������1��������[CO(NH2)2]ˮ��Һ�ȷֽ�ΪNH3��CO2 �� ���ԭ���غ㣬������Ӧ�Ļ�ѧ����ʽΪCO(NH2)2+H2O ![]() 2NH3��+CO2������NH3�ڴ��������»�ԭNO2���ɵ�����ˮ�����ݵ����غ��ԭ���غ�ɵô˷�Ӧ�Ļ�ѧ����ʽΪ8NH3+6NO2
2NH3��+CO2������NH3�ڴ��������»�ԭNO2���ɵ�����ˮ�����ݵ����غ��ԭ���غ�ɵô˷�Ӧ�Ļ�ѧ����ʽΪ8NH3+6NO2![]() 7N2+12H2O����SO2��O2��������NH3��H2O��Ӧ�γ�(NH4)2SO4 �� �˷�Ӧ��SO2�ǻ�ԭ��������������������ϵ����غ��ԭ���غ�ɵô˷�Ӧ�Ļ�ѧ����ʽΪ2SO2+O2+4NH3+2H2O==2(NH4)2SO4��������NH3����������ʵ���Ϊv1��10-3L�� c1 mol��L1 -v2 ��10-3L��c2 mol��L1 ��
7N2+12H2O����SO2��O2��������NH3��H2O��Ӧ�γ�(NH4)2SO4 �� �˷�Ӧ��SO2�ǻ�ԭ��������������������ϵ����غ��ԭ���غ�ɵô˷�Ӧ�Ļ�ѧ����ʽΪ2SO2+O2+4NH3+2H2O==2(NH4)2SO4��������NH3����������ʵ���Ϊv1��10-3L�� c1 mol��L1 -v2 ��10-3L��c2 mol��L1 �� ![]() =��v1c1-
=��v1c1- ![]() v2c2����10-3mol�����ص����ʵ���Ϊ
v2c2����10-3mol�����ص����ʵ���Ϊ ![]() ��v1c1-
��v1c1- ![]() v2c2����10-3mol����������Һ�����ʵ�����������[
v2c2����10-3mol����������Һ�����ʵ�����������[ ![]() ��v1c1-
��v1c1- ![]() v2c2����10-3mol��60g/mol]��a g��100%=
v2c2����10-3mol��60g/mol]��a g��100%= ![]() ��
�� 


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A.1 mol OD�����Ӻ��е����ӡ���������Ϊ10NA
B.��״���£�4.48 L���麬�еķ�����Ϊ0.2NA
C.��״���£�6.72LNO2��ˮ��Ӧ���ĵ�������������Ϊ0.2NA
D.��ϩ�ͻ�������ɵ�42 g�����������ԭ�ӵĸ���Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����18�֣�2-����-3-�ȱ����ᣨF������Ҫ��ҽҩ�м��壬���Ʊ�����ͼ���£� 
�ش��������⣺
��1��![]() �����в�ͬ��ѧ��������ԭ�ӹ����֣�����ԭ����Ŀ���Ϊ��
�����в�ͬ��ѧ��������ԭ�ӹ����֣�����ԭ����Ŀ���Ϊ��
��2��B������Ϊ��д��������������B������ͬ���칹��Ľṹ��ʽ�� a��������ֻ������ȡ�����һ�Ϊ��λ b�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
��3��������δ���üױ�ֱ�������ķ����Ʊ�B�����Ǿ��ɢ٢ڢ�������Ӧ��ȡB����Ŀ������
��4��д���Ļ�ѧ��Ӧ����ʽ�� �� �ò���Ӧ����ҪĿ������
��5��д����ķ�Ӧ�Լ�����������F�к��������ŵ�����Ϊ��
��6���ڷ�����д����  Ϊ��Ҫԭ�ϣ������ٲ����Ʊ����ļ��ۺ�������̡�
Ϊ��Ҫԭ�ϣ������ٲ����Ʊ����ļ��ۺ�������̡�
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ����ȷ��ʵ������ǣ�������
A.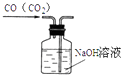
��ȥCO�е�CO2
B.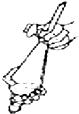
��ȡʱ���Һ
C.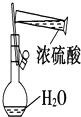
����Ũ����
D.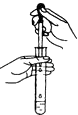
���Թ��еμ�Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����16�֣�ijС������֤��Ӧ��Fe+2Ag+=Fe2++2Ag����ʵ���м�Fe3+ �� ���ֺ�̽���������¡��������ữ��0.05mol��L-1��������Һ��pH��2���м���������ۣ�������ã��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
��1���������
��ȡ������ɫ���壬ϴ�Ӻ��������������֤����ɫ�����к��С�
��ȡ�ϲ���Һ���μ�K3[Fe(CN)6]��Һ��������ɫ������˵����Һ�к�����
��2����ԡ���Һ�ʻ�ɫ��������Ϊ��Һ���У�����Ϊ���۹���ʱ�������У������ݵ�ԭ�����������ӷ���ʽ��ʾ����������ֹ۵����ʵ�飺
��ȡ�ϲ���Һ���μ�KSCN��Һ����Һ��죬֤ʵ�˼IJ²⡣ͬʱ�����а�ɫ��������������Һ��ɫ��dz��������������ȡ��ʱ���йأ��Ա�ʵ���¼���£�
��� | ȡ��ʱ��/min | ���� |
�� | 3 | ����������ɫ��������Һ�ʺ�ɫ |
�� | 30 | ������ɫ��������3 minʱ��С����Һ��ɫ��3 minʱ���� |
�� | 120 | ������ɫ��������30 minʱ��С����Һ��ɫ��3 0minʱ��dz |
�����ϣ�Ag+��SCN-���ɰ�ɫ����AgSCN��
�ڶ�Fe3+������ԭ���������¼��裺
����a�����������۱����������㣬�ܲ���Fe3+��
����b�������д���O2 �� �����������ӷ���ʽ��ʾ�����ɲ���Fe3+��
����c��������Һ��NO3-���������ԣ��ɲ���Fe3+��
����d�����������ж���Һ�д���Ag+ �� �ɲ���Fe3+��
������ʵ����֤ʵ����a��b��c���Dz���Fe3+����Ҫԭ��ʵ����֤ʵ����d������
ʵ����������ữ����Һ��pH��2���м���������ۣ�������ã���ͬʱ��ȡ�ϲ���Һ�μ�KSCN��Һ��3 minʱ��Һ��dz��ɫ��3 0min����Һ������ɫ��
ʵ���װ����ͼ�����м���Һ�� �� ������������
��3������ʵ������Ϸ���ʽ�Ʋ�ʵ�颡~����Fe3+Ũ�ȱ仯��ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�⻯�(LiH)�������Ӿ��壬LiH��ˮ��Ӧ���Էų�������������������ȷ����( )
A.LiH��ˮ��Һ������
B.LiH�������Ӱ뾶������Ӱ뾶��
C.LiH�������ӿ��Ա���ԭ������
D.��Ӧ���ɵ���������ͻ�ԭ�����������Ϊ��12��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�±�ص�˵���������
A. ��Cl2��HCl�������ͨ������ʳ��ˮ�ɵõ�������Cl2
B. HF��HCl��HBr��HI�Ļ�ԭ��������ǿ
C. ���ۣ��⻯��������Һ�ڿ����б�����4I����O2��4H+=2I2��2H2O
D. �������ξ��������ԣ���Ư�ۿ���Ư��֯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]��15�֣� �غ͵����ػ������ڻ�����ҽҩ�����ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1��Ԫ��K����ɫ��Ӧ���Ϻ�ɫ��������ɫ��Ӧ�ķ��䲨��Ϊ_______nm�����ţ���
A.404.4
B.553.5
C.589.2
D.670.8
E.766.5
��2����̬Kԭ���У��������ռ�ݵ�����ܲ�ķ����� �� ռ�ݸ��ܲ���ӵĵ���������ͼ��״Ϊ��K��Cr����ͬһ���ڣ��Һ����������ӹ�����ͬ��������K���۵㡢�е�ȶ��Ƚ���Cr�ͣ�ԭ������
��3��X��������ⶨ�ȷ��֣�I3AsF6�д���I3+���ӡ�I3+���ӵļ��ι���Ϊ �� ����ԭ�ӵ��ӻ�����Ϊ��
��4��KIO3������һ���������õķ����Թ�ѧ���ϣ����и��ѿ��͵�����ṹ���߳�Ϊa=0.446nm��������K��I��O�ֱ��ڶ��ǡ����ġ�����λ�ã���ͼ��ʾ��K��O�����̾���Ϊnm����K���ڵ�O����Ϊ�� 
��5����KIO3�����ṹ����һ�ֱ�ʾ�У�I���ڸ�����λ�ã���K����λ�ã�O����λ�á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ȷ�Ӧ���ǣ� ��
A.C+CO2 ![]() 2CO
2CO
B.Fe+H2SO4�TFeSO4+H2��
C.2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
D.2Na2O2+2H2O�T4NaOH+O2��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com