
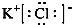 ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).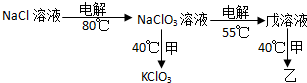
分析 氯酸钾在400℃以上则分解并放出氧气生成氯化钾,分解分为两步进行:加热到356℃以上时分解为氯化钾和高氯酸钾,高氯酸钾受热分解生成氯化钾和氧气,依据原子个数守恒结合图表转化可知甲为氯化钾,乙为高氯酸钾,丙为氧气,依据丁标准状况下密度约为3.01g•L-1,可知M(丁)=3.01g•L-1×22.4L/mol=67.4g/mol,可知丁为二氧化氯,以此解答该题.
解答 解:氯酸钾在400℃以上则分解并放出氧气生成氯化钾,分解分为两步进行:加热到356℃以上时分解为氯化钾和高氯酸钾,高氯酸钾受热分解生成氯化钾和氧气,依据原子个数守恒结合图表转化可知甲为氯化钾,乙为高氯酸钾,丙为氧气,依据丁标准状况下密度约为3.01g•L-1,可知M(丁)=3.01g•L-1×22.4L/mol=67.4g/mol,可知丁为二氧化氯,
(1)氯化钾为离子化合物,是由钾离子与氯离子通过离子键形成,电子式为: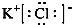 ; 根据题意氯酸钾在高温下分解生成氯化钾和高氯酸可知,高氯酸钾稳定性强于氯酸钾,即:KClO3<KClO4,故答案为:
; 根据题意氯酸钾在高温下分解生成氯化钾和高氯酸可知,高氯酸钾稳定性强于氯酸钾,即:KClO3<KClO4,故答案为: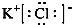 ;<;
;<;
(2)氯酸钾不稳定,在加热条件下可发生分解生成氯化钾和氧气,可将分解后的固体溶于水,加入硝酸酸化的硝酸银,如生成白色沉淀,则证明氯酸钾中含氯元素,
故答案为:将氯酸钾加热分解,将固体产物溶于水,再加入用硝酸酸化的AgNO3溶液,产生白色沉淀,则证明氯酸钾中含氯元素;
(3)①电解氯化钠溶液生成氢氧化钠和氯气、氢气,化学方程式为:2NaCl+2H2O=2NaOH+H2↑+Cl2↑①,氯气与热的氢氧化钠发生反应:6NaOH+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$5NaCl+NaClO3+3H2O②,①×3+②得:NaCl+3H2O$\frac{\underline{\;通电\;}}{80℃}$NaClO3+3H2↑,
当温度低于80℃时,会有部分NaClO生成,若NaCl、NaClO、NaClO3的混合物中氯元素的质量分数为50%,由于混合物种n(Na):n(Cl)=1:1,则钠的质量分数为$\frac{23}{35.5}$×50%=32.4%,则混合物中氧元素的质量分数为1-50%-32.4%=17.6%,
故答案为:NaCl+3H2O $\frac{\underline{\;通电\;}}{80℃}$NaCO3+3H2↑;17.6%;
②NaClO3溶液和KCl发生复分解反应制得KClO3,化学方程式为NaClO3+KCl$\frac{\underline{\;40℃\;}}{\;}$KClO3+NaCl,故答案为:NaClO3+KCl$\frac{\underline{\;40℃\;}}{\;}$KClO3+NaCl;
③电解NaClO3生成高氯酸钠,阳极氯酸根离子失去电子生成高氯酸根离子,电极反应式为:ClO3--2e-+2OH-=ClO4-+H2O;
故答案为:ClO3--2e-+2OH-=ClO4-+H2O;
④依据丁标准状况下密度约为3.01g•L-1,可知M(丁)=3.01g•L-1×22.4L/mol=67.4g/mol,可知丁为二氧化氯,NaClO3溶液用H2SO4酸化后,通入SO2气体,发生反应生成二氧化氯和硫酸钠,依据得失电子守恒配平化学方程式为:2ClO3-+SO2=2ClO2+SO42-,
故答案为:2ClO3-+SO2=2ClO2+SO42-.
点评 本题为无机物的推断,为高频考点,题目难度较大,侧重考查氧化还原反应规律、电解池工作原理,准确把握给出信息,熟悉框图中物质转化的关系是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 10mL0.1 mol•L-1的AlCl3溶液 | B. | 20mL0.1 mol•L-1的CaCl2溶液 | ||
| C. | 30mL0.2 mol•L-1的KCl溶液 | D. | 100mL0.25 mol•L-1的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
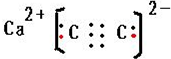 ;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).
;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
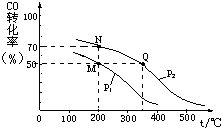 开发新能源和三废处理都是可持续发展的重要方面.
开发新能源和三废处理都是可持续发展的重要方面.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.2×10-3mol | B. | 3.2×10-3mol | C. | 4.4×10-3mol | D. | 4.8×10-3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
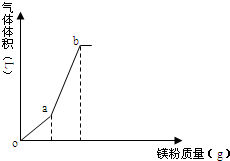 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )| A. | o点时,溶液显酸性的主要原因为:NH4++H2O═NH3•H2O+H+ | |
| B. | oa段溶液pH增大,c(NH4+)减小 | |
| C. | b点溶液显中性 | |
| D. | a、b点气体体积比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和C可形成一种含不同类型的化学键的碱性氧化物 | |
| B. | D2-离子在水溶液中与Al3+、H+均不能大量共存 | |
| C. | A2B的稳定性强于A2D的稳定性 | |
| D. | A2D和DB2可发生氧化还原反应,其中氧化产物与还原产物的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
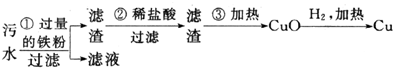
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com