
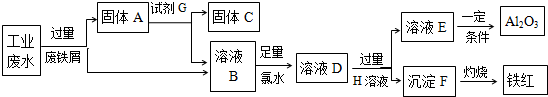
分析 某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,先加过量铁2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+,由于铁过量,所以所得固体A包括Fe和Cu,G为稀盐酸或稀硫酸,C为Cu,B为Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,生成+3价的铁离子,然后加入过量的NaOH溶液,E为NaAlO2溶液,可在溶液中通入二氧化碳气体,生成氢氧化铝沉淀,分解可生成氧化铝,沉淀F为Fe(OH)3,加热分解可生成氧化铁,
(1)某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,先加过量铁2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,发生Fe+Cu2+═Cu+2Fe2+,由于铁过量,所以所得固体包括Fe和Cu;
(2)过滤所得溶液B中含有Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,生成+3价的铁离子,2Fe2++Cl2=2Fe3++2Cl-;
(3)根据工业废水中加入铁以后发生的反应来确定溶液中的离子;
(4)金属铁可以和盐酸、稀硫酸之间反应,但是金属铜和稀盐酸、稀硫酸之间不反应,据此实现金属铁和铜的分离,铝离子可以和氢氧根离子之间反应生成可溶溶液,可以实现铝离子和亚铁离子的分离.
解答 解:(1)根据流程图中可以知道,完成回收铁红、Al2O3和金属Cu,先加过量铁粉,2Fe3++Fe═3 Fe2+,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,Cu2++Fe=Fe2++Cu,过滤得到Fe、Cu,
故答案为:Fe、Cu;
(2)过滤所得溶液B中含有Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化,2Fe2++Cl2=2Fe3++2Cl-;该反应中氯气中氯元素从0价变为产物中的氯离子,化合价降低是氧化剂,故答案为:2Fe2++Cl2=2Fe3++2Clˉ;
(3)金属铁可以和铁离子、铜离子之间反应,过滤所得溶液B中含有Al3+、Fe2+,故答案为:Fe2+、Al3+(H+);
(4)金属铁可以和盐酸、稀硫酸之间反应,但是金属铜和稀盐酸、稀硫酸之间不反应,据此实现金属铁和铜的分离,所以试剂G是稀盐酸或是稀硫酸,分离Al3+、Fe2+,需加强碱,氢氧化铝既可以和强酸反应还可以和强碱反应,溶液E焰色反应呈黄色说明含有钠离子,说明试剂H是氢氧化钠;
故答案为:NaOH.
点评 本题以工业废水中回收铁红、Al2O3和金属Cu考查了物质的分离和提纯,注意根据物质的性质选择分离提纯的方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 14g N2和32g O2 | B. | 34g NH3 和4g H2 | ||
| C. | 2LCO2和2LH2O | D. | 11.2LO2和0.5molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20Ne和22Ne互为同位素 | B. | 20Ne和22Ne互为同素异形体 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne的中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯硅广泛应用于太阳能电池、计算机芯片和半导体器件的制造 | |
| B. | 煤炭经气化、液化和干馏等过程,可以转化为清洁燃料和化工原料 | |
| C. | PM2.5是指直径接近2.5×10-6m的颗粒物分散在空气中形成的污染物的胶体 | |
| D. | 门捷列夫在前人的基础上发现了元素周期律,表明科学研究既要继承又要创新 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使溴水褪色发生加成反应 | B. | 可以在空气中燃烧 | ||
| C. | 与Cl2发生取代反应 | D. | 能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色 | B. | 乙烯使酸性高锰酸钾褪色 | ||
| C. | 甲苯使酸性高锰酸钾褪色 | D. | 乙醇使酸性高锰酸钾褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com