
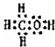 .
.分析 A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,据此解答.
解答 解:A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,
电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,
故答案为:第三周期第ⅢA族;O2->Na+>Al3+;
(2)由H、C、O三种元素组成的18电子微粒,该微粒中只能含有1个C原子、1个O原子,故含有H原子数目=18-6-8=4,故该微粒结构简式为CH3OH,电子式为: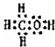 ,
,
故答案为: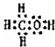 ;
;
(3)A2W2为H2O2,是二元弱酸,其第一步电离的电离方程式为H2O2?H++HO2-,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2,
故答案为:H2O2?H++HO2-;BaO2+H2SO4=BaSO4↓+H2O2;
(4)NaH能与水反应放氢气,同时生成氢氧化钠,该反应的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑;
(5)钠的某化合物呈淡黄色,该化合物为过氧化钠,由于Na2O2和Fe2+的物质的量之比为1:2,反应没有气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3,反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+,
故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+.
点评 本题考查结构性质位置关系综合应用,侧重对化学用语的考查,推断元素是解题关键,题目涉及金属氢化物在中学中基本不接触,注意对基础知识的理解掌握,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶液中通少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 向Ca(ClO)2溶液中通入过量SO2:Ca2++2ClO-+SO2+H2O═CaSO4↓+2H++Cl-+HClO | |
| C. | 用新制的氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| D. | 在碳酸氢钙溶液中加入过量的氢氧化钙溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别取固体样品,滴加同浓度盐酸,观察产生气泡的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2→H2CO3 | B. | Al(OH)3→Al2O3 | C. | Na2O2→Na2CO3 | D. | SiO2→H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com