

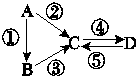
分析 (1)根据仪器的结构来分析;
(2)容量瓶在使用前一定要查漏;
(3)制取蒸馏水的过程必须用酒精灯加热;实质是蒸馏过程,冷凝管下口是进水口,上口是出水口;
(4)根据配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误.
解答 解:(1)根据仪器的结构可知,①为蒸馏烧瓶,②为冷凝管,④为容量瓶,故答案为:蒸馏烧瓶,冷凝管,容量瓶;
(2)容量瓶在使用前一定要查漏,故答案为:④;
(3)利用蒸馏装置分离酒精和水的混合物,必须使用温度计,制取蒸馏水的实质是蒸馏过程,冷凝管下口是进水口,上口是出水口,
故答案为:温度计;蒸馏;g;
(4)配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅,配制多大体积的溶液则选择多大规格的容量瓶,故答案为:应该选用250毫升容量瓶;未用玻璃棒引流.
点评 本题考查化学实验的基本操作,题目难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.


科目:高中化学 来源: 题型:解答题
 根据物质性质完成下列题型.
根据物质性质完成下列题型.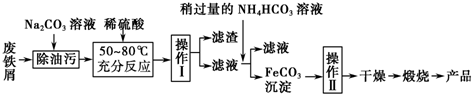
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
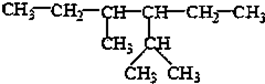 的系统命名为2,4-二甲基-3-乙基乙烷.
的系统命名为2,4-二甲基-3-乙基乙烷.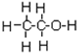 乙烯的电子式
乙烯的电子式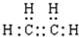
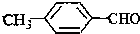 <
<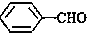
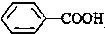 >CH3COOH(提示:类比酚和醇的酸性)
>CH3COOH(提示:类比酚和醇的酸性)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
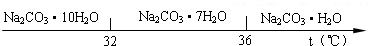
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe (OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
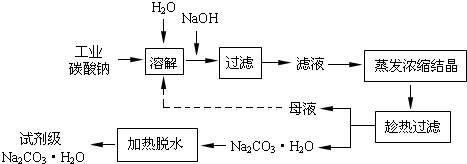
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| B. | 在常温常压下,11.2 升氯气含有的分子数为0.5NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 1 molFe与足量的Cl2反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应 | |
| B. | 人造纤维,合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
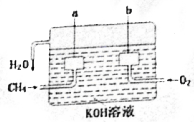 美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池.燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式.
美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池.燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com