
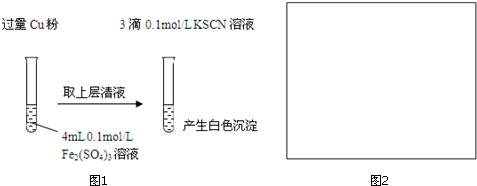
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| :步骤2:取取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 无明显现象 |
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
分析 (1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子;
(2)图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验;
由题目信息ii可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2;
(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水;
(4)①反应速率快的反应现象最先表现;
②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,可以用K3[Fe(CN)6]溶液检验;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡发生移动,最终Fe(NO)2+完全转化为Fe3+;
(5)利用原电池原理,使NO与Fe2+在不同的电极区域生成.
解答 解:(1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子,反应离子方程式为:2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(2)由反应2Fe3++Cu═2Fe2++Cu2+,可知图1中得到溶液中Fe2+为0.2mol/L,Cu2+为0.1mol/L,分别取相同浓度的硫酸铜溶液、硫酸亚铁溶液,滴入KSCN溶液进行对照实验,故实验方案为:
步骤1:取4mL 0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液,
步骤2:取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液,
由题目信息ii可知,Cu2+与SCN-反应生成CuSCN沉淀,同时生成(SCN)2,反应离子方程式为:2Cu2++4SCN-=2CuSCN↓+(SCN)2,
故答案为:0.1;取4mL 0.1mol/L FeSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液;2Cu2++4SCN-=2CuSCN↓+(SCN)2;
(3)亚铁离子具有还原性,酸性条件下硝酸根具有强氧化性,反应生成铁离子、NO与水,反应离子方程为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(4)①溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,反应Ⅰ的速率比反应Ⅱ的慢,
故答案为:慢;
②反应中硝酸过量,若存在平衡,溶液中含有Fe2+,否则没有Fe2+,具体的实验方案是:取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应,
故答案为:取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是不可逆反应;
③Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色,
故答案为:Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色;
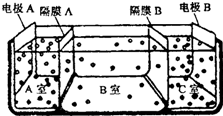
(5)利用原电池原理,使NO与Fe2+在不同的电极区域生成,实验装置图为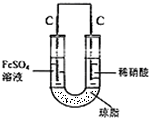 ,
,
故答案为: .
.
点评 本题考查反应原理的探究实验、实验方案设计等,注意利用对照法分析解答,较好的考查学生阅读能力、知识获取与迁移运用能力,注意中学常见仪器与装置的绘画.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.
CH3Cl为无色、略带臭味的气体,密度为2.25g•L-1,沸点为-23.7℃,难容于水,易溶于乙醇和丙醇等有机溶剂.实验室将甲醇与浓盐酸共热(ZnCl2作催化剂)制备CH3Cl,某化学实验小组利用下列装置制备并探究CH3Cl的性质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
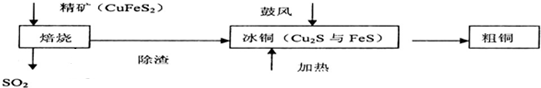
| A. | 焙烧时硫元素全部转化为二氧化硫 | B. | 在焙烧时氧化剂只有氧气 | ||
| C. | 粗铜精炼时用粗铜做阴极 | D. | Cu2S可用于火法炼制铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
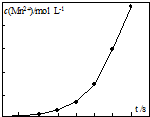 草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
草酸钠滴定法测定高锰酸钾的质量分数步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com