
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |
分析 A.由气态水变为液态,放出热量;
B.根据C元素的化合价变化来计算转移的电子;
C.根据盖斯定律及物质的量与反应热的数值关系来解答;
D.反应$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),1molCH4反应转移8mol电子.
解答 解:A.由CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,水由气态变为液态,放出热量,则CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)△H=-Q,Q>574kJ•mol-1,所以)△H<-574 kJ•mol-1,故A错误;
B.两个反应中,C元素的化合价均由-4价升高到+4价,则等物质的量的甲烷分别参加反应①、②,反应转移的电子数相同,故B正确;
C.$\frac{①+②}{2}$可知CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol,标准状况下4.48LCH4其物质的量为0.2mol,则放出的热量为0.2mol×867kJ=173.4kJ,故C正确;
D.CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),1molCH4反应转移8mol电子,则用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为0.2mol×8=1.6mol,故D正确;
故选A.
点评 本题考查热化学反应及盖斯定律,明确热化学反应的关系及物质的状态、反应热的数值与物质的量的关系即可解答,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间生成n摩尔A,同时生成3n摩尔B | |
| B. | A,B,C的浓度不再变化 | |
| C. | A,B,C的分子数之比为1:3:2 | |
| D. | V正=V逆=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| [H2]/mol•L-1 | [Cl2]/mol•L-1 | v/mol•L-1•s-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1、n=1 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$、n=1 | D. | m=1、n=$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入适量NaCl溶液的方法除去Cu(NO3)2溶液中的AgNO3杂质 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | |
| C. | 向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 先后添加石蕊试液、BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
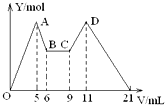 向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )
向MgCl2、AlCl3的混合溶液开始滴加6mol/L的试剂A,之后改滴试剂B,所得沉淀物质的量Y(mol)与试剂体积V(mL)间的关系如图所示.以下结论不正确的是( )| A. | 从6到9,相应离子反应方程式为H++OH-=H2O | |
| B. | A 是NaOH,B是盐酸,且c(NaOH):c( HCl)=2:1 | |
| C. | 原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:1:5 | |
| D. | A是盐酸,B是NaOH,且c(NaOH)=2c (HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;
(1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com