
 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.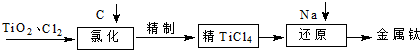
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
| c(TiCl4)?c2(CO) |
| c2(Cl2) |
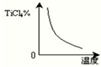 ,
,| c(TiCl4)?c2(CO) |
| c2(Cl2) |
 ;
;

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、P既是氧化剂又是还原剂,CuSO4只是还原剂 |
| B、Cu3P既是氧化产物又是还原产物 |
| C、1mol CuSO4可以氧化1/5molP |
| D、若有11molP参加反应,转移电子的物质的量为60mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 过量NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作步骤 | ①加入1ml | ②滴两滴肝脏研磨液,并混合均匀 | ③加入2ml3%的H2O2,混合均匀 | 实验结果 |
| 1号试管 | 水 | |||
| 2号试管 | 5%NaOH溶液 | |||
| 3号试管 | 5%HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液滴加氯水和CCl4,振荡、静置分层后,下层溶液显紫色,则原溶液中有I- |
| B、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- |
| D、某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大.A原子、C原子的L电子层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子的外围电子排布式为3d104s1.请填空:
已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大.A原子、C原子的L电子层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子的外围电子排布式为3d104s1.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 molCO2为22.4L |
| B、标准状况下,1mol水体积为22.4L |
| C、相同状况下,1molH2和O2所占体积相同 |
| D、只有在标准状况下气体摩尔体积才是22.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com