下列说法正确的是( )
A.4.0g碳化硅晶体中所含C-Si数为0.4NA
B.PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构
C.电解精炼铜时,当阳极质量减少3.2 g时,电路中转移的电子数为0.1NA
D.若H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ?mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ
【答案】
分析:A、碳化硅晶体结构与金刚石类似,每个C原子掌握有4个Si原子,每个Si原子掌握有4个C原子,每个C原子呈4个C-Si键,根据n=
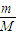
计算碳化硅的物质的量,再根据N=nN
A计算C-Si键数目;
B、BF
3中B原子、HClO中H原子不满足8电子稳定结构;
C、电解精炼铜时,阳极失电子的物质除铜外,其它部分杂质也发生氧化反应;
D、Ba(OH)
2 1 mol溶液与1 mol稀H
2SO
4反应生成2mol水与1mol硫酸钡沉淀,生成硫酸钡沉淀也放出热量.
解答:解:A、4.0g碳化硅晶体的物质的量为
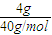
=0.1mol,每个C原子掌握有4个Si原子,每个Si原子掌握有4个C原子,每个C原子呈4个C-Si键,所以含有的C-Si键数目为0.1mol×4×N
Amol
-1=0.4N
A,故A正确;
B、PCl
3中各原子满足8电子结构,BF
3中B原子、HClO中H原子不满足8电子稳定结构,故B错误;
C、电解精炼铜时,阳极失电子的物质除铜外,其它部分杂质也发生氧化反应,当阳极质量减少3.2 g时,电路中转移的电子数不一定为0.1N
A,故C错误;
D、Ba(OH)
2 1 mol溶液与1 mol稀H
2SO
4反应生成2mol水与1mol硫酸钡沉淀,生成硫酸钡沉淀也放出热量,所以放出的热量应大于114.6 kJ,故D错误;
故选A.
点评:本题考查晶体与分子结构、电解原理、热化学方程式等,难度中等,注意A中结构与金刚石类似,但不是C-Si键为C原子提供

个键.

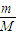 计算碳化硅的物质的量,再根据N=nNA计算C-Si键数目;
计算碳化硅的物质的量,再根据N=nNA计算C-Si键数目;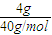 =0.1mol,每个C原子掌握有4个Si原子,每个Si原子掌握有4个C原子,每个C原子呈4个C-Si键,所以含有的C-Si键数目为0.1mol×4×NAmol-1=0.4NA,故A正确;
=0.1mol,每个C原子掌握有4个Si原子,每个Si原子掌握有4个C原子,每个C原子呈4个C-Si键,所以含有的C-Si键数目为0.1mol×4×NAmol-1=0.4NA,故A正确; 个键.
个键. 


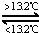 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,