
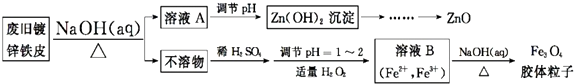
分析 根据实验流程图可知:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子.
(1)Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用;
(2)调节溶液A的pH可产生Zn(OH)2沉淀,过滤、洗涤就可以得到氢氧化锌沉淀,高温灼烧氢氧化锌分解得到ZnO;
(3)持续通入N2,防止Fe2+被氧化;
(4)Fe3O4胶体粒子能透过滤纸;
(5)根据m=cVM计算m(K2Cr2O7);根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,用250mL容量瓶用于配置溶液,胶头滴管用于加水定容;
(6)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$对V(标准)的影响来判断.
解答 解:(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,
故答案为:AB;
(2)调节溶液A的pH可产生Zn(OH)2沉淀,过滤就可以得到氢氧化锌沉淀,洗涤除去附着的离子,高温灼烧氢氧化锌分解得到ZnO,
故答案为:过滤、洗涤、灼烧;
(3)Fe2+容易被氧化,持续通入N2,防止Fe2+被氧化;
故答案为:在N2气氛下,防止Fe2+被氧化;
(4)Fe3O4胶体粒子能透过滤纸,所以不能用过滤的方法实现固液分离,故答案为:不能;胶体粒子太小,抽滤时容易透过滤纸;
(5)m(K2Cr2O7)=0.01000mol•L-1×0.250 L×294.0 g•mol-1=0.7350g;
根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,用玻璃棒搅拌,恢复室温,用玻璃棒引流,移入250mL容量瓶中,继续加水至离刻度线1-2cm处,改用胶头滴管加水定容,故用不到的仪器为量筒和移液管,
故答案为:0.7350;③⑦;
(6)滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,造成消耗的V(标准)偏大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,则测定结果偏大;
故答案为:偏大.
点评 本题以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查实验基本操作和技能,涉及标准溶液的配制及滴定的误差分析、对信息的利用、实验条件的控制等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 只由非金属元素组成的化合物一定是共价化合物 | |
| B. | 只含离子键的纯净物一定是离子化合物 | |
| C. | Cl2和H2O两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 固体二氧化硫是分子晶体,其溶于水生成亚硫酸的过程只需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.
掌握仪器的名称及使用方法是化学实验的基础,如图所示为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
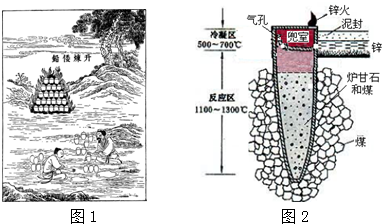
| A. | “泥封”的目的是为了防止得到的锌被氧化 | |
| B. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 | |
| C. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| D. | 升炼倭铅过程包含分解反应和氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 25℃,1.01×105 Pa,32 g O2和O3的混合气体所含原子数为2.5NA | |
| C. | 标准状况下,11.2 L H2O含有的原子数为1.5NA | |
| D. | 常温常压下,44 g CO2含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②⑤ | C. | ④⑤ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然的油脂大多数为混甘油酯 | |
| B. | 油脂在碱性条件下水解更彻底,工业应用该反应制肥皂 | |
| C. | 油脂分为液态的油和固体的脂肪 | |
| D. | 油脂没有不饱和双键,所以,油脂不能使高锰酸钾溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com