
【题目】在密闭容器中发生反应aX(g)+bY(g)=cZ(g)+dW(g),反应达到平衡后,保持温度不变,将容积扩大到原来的2倍,当再次达到平衡时,W的浓度为原平衡时的3/5,下列叙述正确的是( )
A. 平衡向逆反应方向移动 B. a+b<c+d
C. X的体积分数增大 D. X的转化率减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是___;C元素在元素周期表中的位置是___;甲的电子式是___。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是___;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈___(填“酸”或“碱”)性,用电离方程式表示其原因是___。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试是___。
②A、C组成的化合物中,化学式为C2A6,该物质与D的单质发生反应的类型___,写出其中一个化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法不正确的是
A. 用如图电子天平称量固体,读数时侧门应关闭

B. 用托盘天平称取10.2 g NaOH固体时,将10g的砝码放在右盘,将游码移到0.2g的位置
C. 分光光度计可用于分析溶液颜色与反应物(生成物)浓度的关系,从而确定化学反应速率
D. 吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________;
(4)用电子式表示MgCl2的形成过程 _____________________;
(5)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436 kJ、946 k J、391 k J。则由N2和H2反应生成1 mol NH3 需要放出_____的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是
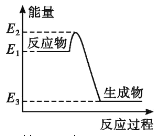
A. 如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C. 金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可为:C(s金刚石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同温同压下,H2(g)+C12(g)==2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到下表中的两组数据:下列说法正确的是( )
实验 编号 | 温度/℃ | 平衡常数 /mol﹣1L | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | |||
1 | T1 | K1 | 4 | 2 | x | 0.8 |
2 | T2 | K2 | 4 | 2 | 0.4 | y |
A. x=2.4,y=0.2 B. T1、T2的大小:T1<T2
C. K1、K2的大小:K1<K2 D. T1℃时,若起始量增倍,K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:____________________
(2)配平该方程式____FeC2O4·H2O+___H2O+ __K2 C2O4+__H 2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式______;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:![]() 。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020, K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?______(填“是”或“否”)若选“否”,请设计检验铁元素的方案_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)反应过程中末端导管必须插入试管C的水中,目的是____。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(2)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=____。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_____。
(二)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
6SO2+Fe3O4,若有3molFeS2参加反应,转移电子的物质的量为_____。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____。
(3)将一定量的Fe2O3溶于160mL 5molL-1盐酸中,再加入一定量铁粉,铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com