
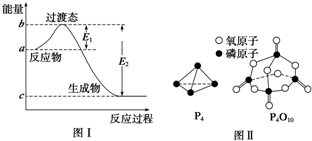
| 1 |
| 2 |
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ?mol-1 | a | b | c | x |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 6a+5c+d-12b |
| 4 |
| 6a+5c+d-12b |
| 4 |


科目:高中化学 来源: 题型:
| 选项 | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
| C | 在容积可变的密闭容器中发生反应:2NH3(g)?N2H4(l)+H2(g),把容积的体积缩小一半 | 正反应速率加快,逆反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ①图象中曲线
①图象中曲线| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:

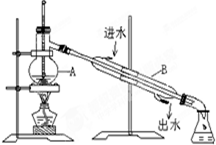 图中装置中仪器的名称:
图中装置中仪器的名称:查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、中性溶液的AG=1 |
| B、酸性溶液的AG<0 |
| C、常温下0.lmol/L氢氧化钠溶液的AG=12 |
| D、常温下0.lmol/L盐酸溶液的AG=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有一反应,由X与Y化合生成Z.其反应如右:2X+3Y=2Z,反应物X与生成物Z的质量关系如图.下列说法正确的是( )
有一反应,由X与Y化合生成Z.其反应如右:2X+3Y=2Z,反应物X与生成物Z的质量关系如图.下列说法正确的是( )| A、有4g的Z生成时,则消耗Y 6g |
| B、X、Y、Z的摩尔质量之比为3:2:6 |
| C、2mol X质量与3mol Y质量之和等于2mol Z的质量 |
| D、消耗2mol X时,在标准状况下,生成Z的体积为44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:P>S>Cl>H |
| B、热稳定性:NH3>PH3>H2S>HCl |
| C、酸性:HClO4>H2SiO3>H3PO4>H2CO3 |
| D、元素非金属性:F>O>N>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热化学方程式中化学计量数表示分子个数 |
| B、该反应的△H2=+483.6 kJ/mol |
| C、形成2mol H-O键放出能量比断2mol H-H及1mol O=O键所需能量多483.6kJ |
| D、|△H2|>|△H1| |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 光 |
| 方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com