
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | SO2具有氧化性,可用于漂白纸浆 | |
| C. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中混有的少量SO2,可将气体通过酸性高锰酸钾溶液 | |
| B. | 除去SiO2中混有的少量Al2O3,可以用NaOH溶液洗涤 | |
| C. | 除去Fe粉中的少量Mg粉,可以将该粉末用稀硝酸洗涤,然后过滤 | |
| D. | 除去NO2气体中混有的少量NO气体,可以向该气体中充入过量空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->Cl2>I2>Fe3+ | B. | Cl2>ClO3->I2>Fe3+ | ||
| C. | ClO3->Cl2>Fe3+>I2 | D. | ClO3->Fe3+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 | |
| B. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| C. | 氢氧燃料电池、丹尼尔电池、硅太阳能电池中都利用了原电池原理 | |
| D. | 纤维素、PLA、纤维二糖、甲壳素、硝化纤维等都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之
如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应.A、B、C都可以被强还原剂还原成为D(C6H14O6).已知,相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之  最难.
最难.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 | |
| B. | 硅为半导体,常用作光导纤维 | |
| C. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
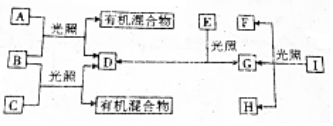
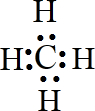 ,有机物C的结构简式为
,有机物C的结构简式为 ,其苯环上的二氯代物共有6种.
,其苯环上的二氯代物共有6种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com