
 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:分析 (1)步骤1中向上清液中继续加NaCl溶液看是否有沉淀,可判断所加氯化钠是否足量;
(2)步骤2加热时产生的能使澄清石灰水变浑浊的气体为二氧化碳,反应生成了Ag、Al(OH)3,由电荷守恒可知应生成NaCl,根据元素守恒应有水参加反应,结合原子守恒和电荷守恒书写;
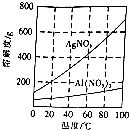
(3)硝酸银溶解度随温度升高而增大且受温度影响比较大,而硝酸铝溶解度受温度影响不大,可向沉淀中加入足量稀盐酸,过滤,向沉淀中加入足量稀硝酸,充分反应后,过滤,将所得滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,可得硝酸银固体;
(4)①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液;
③计算消耗NH4SCN的物质的量,根据Ag++SCN-=AgSCN↓可求得硝酸银的质量,进而确定质量分数.
解答 解:(1)步骤1中检验所加NaCl溶液已经足量的方法是:静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量,
故答案为:静置,向上层清液中继续滴加NaCl溶液,若溶液不变浑浊,则NaCl已足量;
(2)步骤2加热时产生的能使澄清石灰水变浑浊的气体为二氧化碳,反应生成了Ag、Al(OH)3,由电荷守恒可知应生成NaCl,根据元素守恒应有水参加反应,反应离子方程式为:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑,
故答案为:2Al+6AgCl+3CO3 2-+3H2O=2Al(OH)3+6Ag+6Cl-+3CO2↑;
(3)步骤2中所得灰白色沉淀主要含有Ag、Al(OH)3和少量仍未反应的AgCl,可向沉淀中加入足量稀盐酸,充分反应后,过滤,洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤,将所得滤液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,可得硝酸银固体,
故答案为:加入足量稀盐酸,充分反应后,过滤;洗涤沉淀,向沉淀中加入足量稀硝酸,充分反应后,过滤;将所得滤液蒸发浓缩、冷却结晶,过滤;用冰水洗涤、干燥;
(4)①配制100mL一定物质的量浓度的溶液,所需要的玻璃离仪器有烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
②用 NH4SCN标准溶液滴定硝酸银溶液,滴定终点时,SCN-与铁离子结合生成血红色溶液,所以滴定终点的实验现象为:溶液变为(血)红色,
故答案为:溶液变为(血)红色;
③NH4SCN标准溶液的平均体积为29.00mL,则NH4SCN的物质的量为0.1000mol•L-1×0.029L=2.9×10-3 mol,根据Ag++SCN-=AgSCN↓可知硝酸银的质量为2.9×10-3 mol×170g/mol×$\frac{100mL}{25mL}$=1.972g,所以硝酸银的质量分数为$\frac{1.972g}{2.000g}$×100%=98.60%,
故答案为:98.60%.
点评 本题考查制备实验方案的设计,涉及氧化还原反应、物质的分离提纯、物质含量测定、沉淀滴定原理应用等,综合性较强,基本属于拼合型题目,题目难度中等.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| D. | 蔗糖是还原性糖,能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用农作物秸秆制取乙醇 | |
| B. | 回收地沟油,制备生物柴油 | |
| C. | 焚烧废旧塑料,防止白色污染 | |
| D. | 开发利用各种新能源,减少对化石燃料的依赖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 0.3molFeBr2与0.4molCl2在溶液中反应:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 吸热反应不一定需要加热才能发生 | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)═2CO(g)+O2(g)△H=2×283.0 kJ/mol | |
| C. | HCl和NaOH反应的中加热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W的单质的熔点最高 | |
| B. | X元素的非金属性最强 | |
| C. | 最高价氧化物的水化物按酸性增强碱性减弱的顺序是YZWX | |
| D. | Z的原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com