
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
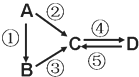
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_________;④反应离子方程式__________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_______________________。④反应的离子方程式______________。D中加入氢氧化钠的现象__________。
(3)若A是太阳能电池用的光伏材料,B常用用于制作高档光学器材,C、D为钠盐,C的水溶液俗称泡花碱,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为____________________。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-3Fe+4H2O(g)![]() Fe3O4+4H2Fe+2Fe3+=3Fe2+生成的白色沉淀迅速变成灰绿色,最后变成红褐色SiO2+2NaOH=Na2SiO3+H2OSiO2+Na2CO3
Fe3O4+4H2Fe+2Fe3+=3Fe2+生成的白色沉淀迅速变成灰绿色,最后变成红褐色SiO2+2NaOH=Na2SiO3+H2OSiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
【解析】
(1)若D物质具有两性,推断D为Al(OH)3,④反应是通入过量的一种引起温室效应的主要气体,气体是二氧化碳,说明C为偏铝酸钠,②③反应均要用强碱溶液,判断A为Al,B为铝盐,则②反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,④反应离子方程式为AlO2-+CO2(过量)+2H2O=Al(OH)3↓+HCO3-;
(2)若A是应用最广泛的金属,A为Fe,铁与水高温下反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;④反应用到A,②⑤反应均用到同一种黄绿色气体单质,推断为Cl2,则C为FeCl3,D为FeCl2,因此④反应的离子方程式为Fe+2Fe3+=3Fe2+;氯化亚铁中加入氢氧化钠的现象为生成的白色沉淀迅速变成灰绿色,最后变成红褐色;
Fe3O4+4H2;④反应用到A,②⑤反应均用到同一种黄绿色气体单质,推断为Cl2,则C为FeCl3,D为FeCl2,因此④反应的离子方程式为Fe+2Fe3+=3Fe2+;氯化亚铁中加入氢氧化钠的现象为生成的白色沉淀迅速变成灰绿色,最后变成红褐色;
(3)若A是太阳能电池用的光伏材料,判断A为Si。B常用用于制作高档光学器材,B是二氧化硅。C、D为钠盐,C的水溶液俗称泡花碱,C是硅酸钠,D的溶液显碱性,④反应也是通入一种引起温室效应的主要气体,即二氧化碳,所以D是碳酸钠。根据以上分析可知③反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O。⑤反应用到B,反应条件为高温,则⑤的化学方程式为SiO2+Na2CO3![]() Na2SiO3+CO2↑。
Na2SiO3+CO2↑。


科目:高中化学 来源: 题型:
【题目】向2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g) ![]() D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g)ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T ℃时,该反应的平衡常数K=____________________________。
(2)30 min后,只改变某一条件,反应重新达到平衡,据表中数据判断改变的条件可能是_____(填编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为下图中的____________(填序号)。
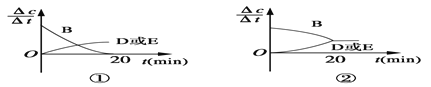

(4)容器的体积和温度T1 ℃不变,向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,投入固体A的物质的量n的取值范围是______。
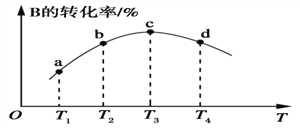
(5)若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中不能达到相应实验目的的是
选项 | A | B | C | D |
方案 |
|
|
|
|
目的 | 探究浓度对化学反应速率的影响 | 探究催化剂对H2O2分解速率的影响 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产环氧乙烷(![]() )的反应为:2CH2=CH2(g)+O2(g)
)的反应为:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) ΔH=-106kJ/mol,其反应机理如下:
(g) ΔH=-106kJ/mol,其反应机理如下:
①Ag+O2→AgO2 慢
②CH2=CH2+AgO2→![]() + AgO 快
+ AgO 快
③CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是
A. 反应的活化能等于106 kJ/mol
B. 该反应的原子利用率为100%
C. AgO2也是该反应的催化剂
D. 增大乙烯的浓度只能显著提高环氧乙烷的生成速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是( )
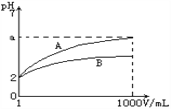
A. A、B两种酸溶液物质的量浓度一定相等
B. 稀释后A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 若A、B都是弱酸,则5≥a>2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:

已知:RCN在酸性条件下发生水解反应:RCN![]() RCOOH
RCOOH
(1)C的分子式为_______________,D→E的反应类型是________________。
(2)F分子中有3个含氧官能团,名称分别为醚键、羧基和______________。
(3)写出A→B 的化学方程式:__________________________________。
(4)E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为________________。
(5)写出符合下列条件的D的一种同分异构体的结构简式:________________。
①分子中有4种不同化学环境的氢;
②可发生水解反应,且一种水解产物能与FeCl3发生显色反应,另一种水解产物能发生银镜反应。
(6)对羟基苯乙酸乙酯(![]() )是一种重要的医药中间体。写出以
)是一种重要的医药中间体。写出以![]() 和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: _______。
_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
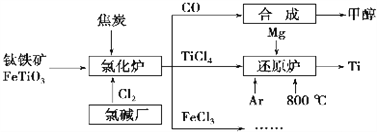
【题目】为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶ 6,则氯化炉中的化学方程为_________________________________________________。
(3)TiCl4在常温下为无色液体,在军事上可作为人造烟雾剂,因为它在湿空气中会大冒白烟,水解生成二氧化钛的水凝胶TiO2·xH2O(也常写成H2TiO),工业上可也用此反应制备TiO2。请写出该水解方程式__________________________________________(用TiO2·xH2O或H2TiO表示均可),工业上用TiCl4制备TiO2·xH2O时要加入大量的水,同时加热,目的是:______________________________
(4)Ar气通入还原炉中并不参与反应,通入Ar气的作用是__________________________
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-= 2CO32-+6H2O,工作一段时间后,测得溶液的pH_____(填“减小”、“增大”或“不变”)。
(6)FeCl3溶液可作为印刷电路铜板的腐蚀液,写出该反应的离子方程式_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列反应的焓变
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g) =CO2(g) △H2=-393.5kJ/mol
③2H2(g)+O2(g) =2H2O(l) △H3=-285.8kJ/mol
试计算反应2C(s)+2H2(g)+O2(g) =CH3COOH(l)的焓变ΔH=_____________kJ/mol。
(2)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________。
(3)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下:
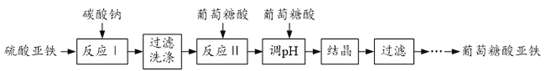
(1)反应Ⅰ的化学方程式为______。
(2)①碳酸亚铁过滤时需在表面保留水层的原因是______;
②检验FeCO3已经洗涤干净的操作为______。
(3)反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是______。
(4)葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是______,______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com