
| A. | SiO2熔点高,可用作光导纤维 | |
| B. | Li还原性强且质轻,常用作负极材料 | |
| C. | Fe2(SO4)3具有氧化性,能用作净水剂 | |
| D. | SO2能杀菌,可用于漂白纸浆 |
分析 A.二氧化硅具有良好的光学特性;
B.依据锂性质活泼溶于失去电子发生氧化反应,密度小的性质;
C.三价铁离子水解生成氢氧化铁胶体具有吸附性;
D.二氧化硫能够与有色物质化合生成无色物质,具有漂白性.
解答 解:A.二氧化硅具有良好的光学特性,可以用于制造光导纤维,与其熔点高性质无关,故A错误;
B.锂性质活泼溶于失去电子发生氧化反应,密度小的性质,常用作电池的负极材料,故B正确;
C.硫酸铁做净水剂是因为三价铁离子水解生成氢氧化铁胶体具有吸附性,能够吸附水中固体杂质颗粒,与氧化性无关,故C错误;
D.二氧化硫漂白纸浆是因为其具有漂白性,二氧化硫能够杀菌无关,故D错误;
故选:B.
点评 本题考查了元素化合物知识,侧重考查物质的用途,性质决定用途,明确相关物质的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新的平衡体系中,N2的浓度小于2c mol/L大于c mol/L | |
| B. | 新的平衡体系中,NH3的浓度小于2c mol/L大于c mol/L | |
| C. | 新的平衡体系中,混合气体的平均摩尔质量小于$\overline{M}$ | |
| D. | 新的平衡体系中,气体的密度是原平衡体系的1倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使广泛pH试纸显红色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 含有大量Al3+的溶液:Na+、Cl-、HCO3-、SO42- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| D. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氯气与足量氢氧化钠溶艘反应转移的电子数为2NA | |
| B. | 将含有1molFeCl3的饱和溶液加入到沸水中得到氢氧化铁胶体,其中胶体粒子的数目为NA | |
| C. | 两份2.7g铝分别与100 mL浓度为2mol•L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA | |
| D. | 通常情况下,16g CH4中含有4NA个C-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是( )| A. | P4S3中磷元素为+3价 | |
| B. | P4S3属于共价化合物 | |
| C. | P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2 | |
| D. | 1 mol P4S3分子中含有9 mol共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
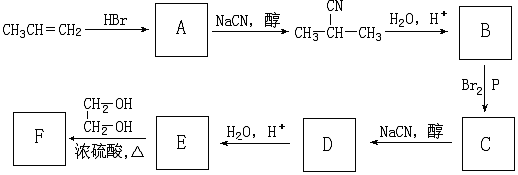
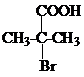 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$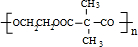 +2nH2O.
+2nH2O.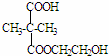 ,②分子内含有一个七元环
,②分子内含有一个七元环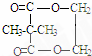 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com