
【题目】常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”)
科目:高中化学 来源: 题型:
【题目】根据下图及描述,回答下列问题: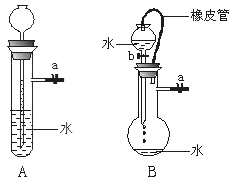
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示.试判断:A装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) , 判断理由: .
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶.试判断:B装置是否漏气?(填“漏气”、“不漏气”或“无法确定”) , 判断理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
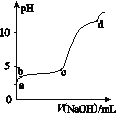
A. a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-![]() Al(OH)3
Al(OH)3
B. a~b段,溶液pH增大,Al3+浓度不变
C. b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D. d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2既可以作氧化剂,又可以作还原剂。现向H2O2溶液中加入强酸酸化的KMnO4溶液,紫红色的KMnO4溶液变成了无色。该强酸性反应体系中,反应物和生成物共六种粒子:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。
(1)写出该反应离子方程式并配平: ____________________________________________________________________。
(2)该反应应选择的酸是:________________ (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
(3)请将氧化剂与还原剂的化学式填入空格中,并标出电子转移的方向和数目__________________。
![]()
(4)如反应中电子转移了0.5 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2 L的恒容密闭容器中发生反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)。
COS(g)+H2O(g)。
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.1 | 0.15 | 0.05 | |
Ⅱ | 607 | 0.2 | 0.3 | ||
Ⅲ | 627 | 0.1 | 0.15 | 6×l0-3 | |
下列说法正确的是
A. 该反应为吸热反应
B. 容器Ⅲ达到平衡时,再充入少量氦气,平衡将向正反应方向移动
C. 容器Ⅱ达到平衡时,容器中COS的物质的量浓度为0.025 mol L-1
D. 607 K时,该反应的平衡常数为0.50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )
A. 原子半径:Cl>S>O B. 还原性:Na>Mg>Al
C. 稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com