
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.分析 (1)依据热化学方程式和盖斯定律计算得到;
(2)根据电池总反应和参加物质的化合价的变化可知,反应中V2+离子被氧化,应是电源的负极,VO2+离子化合价降低,被还原,应是电源的正极反应,根据原电池的工作原理进行分析;
(3)依据平衡常数概念写出该反应的平衡常数表达式,然后通过列式计算,依据浓度商和平衡常数比较分析判断;根据影响化学平衡的因素判断改变的条件;
(4)根据催化剂的特点可知另一个反应一定实现Fe3+→Fe2+,据此写出另一个反应的离子方程式.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律(①+②)÷2得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)依据电极原理分析,充电过程中,H+向阴极区移动,
反应中VO2+离子化合价降低,被还原,应是电源的正极反应,V2+离子被氧化,应是电源的负极,电极反应为:V3++e-=V2+,
故答案为:阴极区;V3++e-=V2+;
(3)反应2NO(g)+2CO(g)?N2(g)+2CO2(g)的平衡常数表达式为:K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,
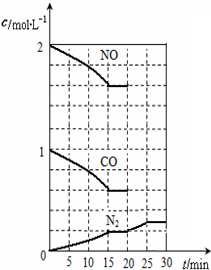
依据图象可知,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0,该温度下该反应的平衡常数为:K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{0.{6}^{2}×1.{6}^{2}}$=0.035,若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,则各组分浓度分别为:c(NO)=1.6mol/L、c(CO)=0.6mol/L+0.6mol/L=1.2mol/L、c(N2)=0.2mol/L+0.6mol/L=0.8mol/L、c(CO2)=0.4mol/L,Qc=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$=$\frac{0.8×0.{4}^{2}}{1.{6}^{2}×1.{2}^{2}}$=0.035=K,则化学平衡不动,20min时,若改变反应条件,导致N2浓度发生如图所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,所以B正确,
故答案为:$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$;不;B;
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2═2Fe2++SO42-+4H+,通过该反应,吸收了大气污染物SO2,同时制得了硫酸,
故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
点评 本题考查了化学平衡的计算、热化学方程式书写及原电池、电解池原理的应用,平衡移动方向判断、反应离子方程式的书写方法等知识,题目难度中等,注意掌握化学平衡及其影响因素,明确化学平衡常数的概念及表达式,能够根据平衡常数及浓度熵判断平衡状态.


科目:高中化学 来源: 题型:解答题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | |
| B. | 工作时电子由Zn极经溶液移向Ag2O极 | |
| C. | 该电池可将化学能100%转化为电能 | |
| D. | Zn是负极,反应为Zn-2 e-+2OH-=Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应活化能小于100 kJ•mol-1 | |
| B. | 逆反应活化能一定小于100 kJ•mol-1 | |
| C. | 正反应活化能不小于100 kJ•mol-1 | |
| D. | 正反应活化能比逆反应活化能小100 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 是原子半径最小的元素 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 是短周期元素中原子半径最大的主族元素. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
| F | 原子有三个电子层,且最外层电子数是最内层电子数的3倍, |
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体KHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量NH4Cl固体,平衡正向移动,c(H+)降低 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | 待测溶液体积 (mL) | 所耗盐酸标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.2 | 21.32 |
| 3 | 20.00 | 1.3 | 21.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com