
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂。可通过反应获得:2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=______________(用K1和K2表示)。
(2)按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强P(总压)的关系如图A所示:
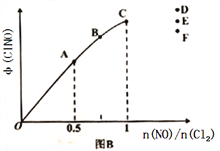
①该反应的△H______0(填“>”“<”或“=”);
②在P压强条件下,M点时容器内NO的体积分数为_________;
③若反应一直保持在P压强条件下进行,则M点的分压平衡常数Kp=__________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
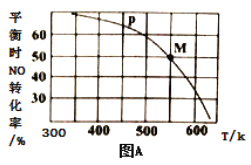
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数的变化图像如图B,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。
【答案】 K12/K2 < 40% Kp=5/P A D
【解析】(1)根据盖斯定律:将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K。
(2)①由图象可知,温度升高,NO转化率减小,平衡左移,该反应正反应为放热反应。②按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率50%,结合三行计算列式计算得到。
(3)根据三段式结合一氧化氮的转化率,计算出平衡浓度, 计算该反应的平衡常数K。
(4)n(NO)/n(Cl2)的比值越小,说明若n(NO)不变,n(C12) 越大,所以NO的转化率越大,NO的转化率最大的是A点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)= 1.5时,产物的含量增大。
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g);②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g);根据盖斯定律:将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),则平衡常数K3= K12/K2;正确答案K12/K2。
(2)①由图象可知,温度升高,NO转化率减小,平衡左移,该反应正反应为放热反应,△H<0;正确答案:<。
②按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率50%,进行如下计算:
2NO(g)+Cl2(g)2ClNO(g)
起始量(mol ) 2 1 0
变化量(mol) 2×50% 0.5 1
平衡量(mol) 1 0.5 1
容器内NO的体积分数=1/(1+0.5+1)×100%=40%;正确答案40%。
③ 2NO(g)+Cl2(g)2ClNO(g)
起始量(mol ) 2 1 0
变化量(mol) 2×50% 0.5 1
平衡量(mol) 1 0.5 1
平衡总物质的量=2.5mol,一氧化氮的分压为0.4p,Cl2的分压为0.2p,ClNO分压为0.4 p;该反应的平衡常数Kp=(0.4p)2/(0.4p)2×0.2p=5/P;正确答案:5/P。
(3)n(NO)/n(Cl2)的比值越小,说明若n(NO)不变,n(C12)越大,所以NO的转化率越大,NO的转化率最大的是A点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)= 1.5时,产物的含量增大,所以应该是D点;正确答案:A ;D。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】美国《Science》上发表论文,宣布发现了一种 Al 的超原子结构,这种超原子(Al13)是以 1 个 Al 原子 在中心,12 个 Al 原子在表面形成的三角二十面体结构。这种超原子具有 40 个价电 子(价电 子即主族元 素的最外层电子数)时最稳定。请预测稳定的 Al13 所带的电荷为
A. -1 B. +2 C. +3 D. 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和水反应生成HCl和HClO,欲从反应混合物中分离出HClO溶液,下列方法可选用的是( )
A.加硫酸钙,充分反应后蒸馏
B.加碳酸钙,充分反应后蒸馏
C.加硝酸钙,充分反应后蒸馏
D.加氯化钙,充分反应后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是

A. 装置①依据褪色快慢探究浓度对反应速率的影响 B. 装置②可用于测定中和热
C. 装置③探究Mg(OH)2能否转化成Fe(OH)3 D. 装置④构成锌—铜原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 14C和14N质量数相同,互为同位素 B. 3He和4He中子数不同,互为同位素
C. 12C和 13N中子数相同,互为同位素 D. 12C和14N含有相同的中子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池正成为化学电源的新宠。
(1)有一种新型的高能电池—钠硫电池(熔融的钠、硫为两极,以Na+导电的βAl2O3陶瓷作固体电解质),反应式为2Na+xS ![]() Na2Sx。
Na2Sx。
①充电时,钠极与外电源________(填“正”或“负”)极相连。其阳极反应式:_____________。
②用该电池作电源电解(如图)NaCl溶液(足量),写出电解NaCl溶液的离子方程式:________________________________。

③若用该钠硫电池作电源在一铁片上镀铜,此铁片与__________(填“钠”或“硫”)极相连。
(2)“Na-CO2”电池可将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用热的氢氧化钠溶液洗去试管内壁沾有的硫单质,发生反应6NaOH+3S![]() 2Na2S+Na2SO3+3H2O。关于该反应的说法不正确的是( )
2Na2S+Na2SO3+3H2O。关于该反应的说法不正确的是( )
A. 硫既是氧化剂又是还原剂 B. 硫化钠是还原产物
C. 硫既表现氧化性又表现还原性 D. 消耗3 mol 硫,转移电子6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该小组同学欲用下图所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。


①应该选择的仪器是________(填字母)。
②浓盐酸与二氧化锰反应的离子方程式为____________________________
(2)该小组同学设计并分别利用下图所示装置探究氯气的氧化性。

①G中的现象是________,原因是__________________(用化学方程式表示)。
②H中的现象是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com