


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
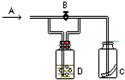 如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条无变化; 打开B阀时,C处干燥的红色布条褪色,则D中的溶液是( )
如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条无变化; 打开B阀时,C处干燥的红色布条褪色,则D中的溶液是( )| A、浓盐酸 |
| B、H2O |
| C、NaOH溶液 |
| D、饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com