

分析 (1)依据配制一定溶质质量分数的方法解答;
(2)下脚料中含有硫酸亚铁,向稀硫酸、铁片发生反应生成硫酸亚铁;
(3)硫酸亚铁为强酸弱碱盐,水解显酸性;
(4)下脚料中含有硫酸亚铁,向稀硫酸、铁片发生反应生成硫酸亚铁,且稀硫酸能抑制硫酸亚铁水解,然后向溶液中加入絮凝剂和水,得到吸附杂质的絮凝剂,然后过滤得到滤液,浓缩结晶滤液,得到FeSO4•7H2O,然后向溶液中加入碳酸氢铵,发生的反应为FeSO4+2NH4HCO3=FeCO3↓+( NH4)2 SO4+CO2↑+H2O,然后洗涤过滤得到A,滤液A为(NH4)2 SO4,根据硫酸根离子的检验方法检验;
(5)硫酸亚铁与 碳酸氢铵反应生成碳酸铁、硫酸铵和二氧化碳、水.
解答 解:(1)配制一定溶质质量分数溶液的方法是:计算、称量、溶解,用到的仪器有:烧杯、玻璃棒,故选:BD;
(2)下脚料中含有硫酸亚铁,向稀硫酸、铁片发生反应生成硫酸亚铁,离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(3)硫酸亚铁为强酸弱碱盐,水解显酸性,所以要保存硫酸亚铁不变质,应加入硫酸,硫酸作用是抑制Fe2+的水解,故答案为:抑制Fe2+的水解;
(4)下脚料中含有硫酸亚铁,向稀硫酸、铁片发生反应生成硫酸亚铁,且稀硫酸能抑制硫酸亚铁水解,然后向溶液中加入絮凝剂和水,得到吸附杂质的絮凝剂,然后过滤得到滤液,浓缩结晶滤液,得到FeSO4•7H2O,然后向溶液中加入碳酸氢铵,发生的反应为FeSO4+2NH4HCO3=FeCO3↓+( NH4)2 SO4+CO2↑+H2O,然后洗涤过滤得到A,滤液A为(NH4)2 SO4,硫酸根离子的检验方法是:加盐酸酸化的氯化钡溶液,如果有白色沉淀生成,表示溶液中含有硫酸根,故答案为:FeSO4•7H2O;SO42-;加盐酸酸化的氯化钡溶液,如果有白色沉淀生成,表示溶液中含有硫酸根;
(5)硫酸亚铁与 碳酸氢铵反应生成碳酸铁、硫酸铵和二氧化碳、水,化学方程式:FeSO4+2NH4HCO3→FeCO3↓+( NH4)2 SO4+CO2↑+H2O;
故答案为:FeSO4+2NH4HCO3→FeCO3↓+( NH4)2 SO4+CO2↑+H2O.
点评 本题通过氧化铁的制备为载体考查了化学方程式的书写、离子浓度大小比较、盐类水解的应用,题目难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素X与Z、Y 与W形成的化合物都为离子化合物 | |
| B. | 元素X与Y,Z与Y形成的二元化合物都只有一种 | |
| C. | Y、Z、W三种元素形成的离子半径随原子序数的增加而增大 | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ν(H2)=0.03 mol•L-1•min-1 | B. | ν(NH3)=1.7 g•L-1•min-1 | ||
| C. | ν(N2)=0.02 mol•L-1•min-1 | D. | ν(NH3)=0.01 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO、Fe2O3 | B. | FeO、Fe3O4 | C. | Fe2O3、Fe3O4 | D. | FeO、Fe2O3、Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |
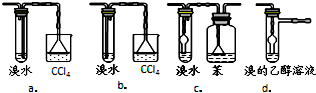

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,
 的同分异构体:
的同分异构体: 、
、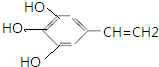 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物主要来自自然界众多的有机体 | |
| B. | 有机物分子中的碳原子成键方式具有多样性 | |
| C. | 可以人工合成 | |
| D. | 可以由无机物进行转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com