
分析 (1)利用盖斯定理,将②-①可得CO燃烧热的热化学方程式;
(2)反应的化学方程式为C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4 H2O(g),结合方程式计算反应热.
解答 解:(1)CO燃烧热的热化学方程式表示1molCO完全燃烧放出热量的热化学方程式,用盖斯定理,将②-①可得CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1,
故答案为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1;
(2)反应的化学方程式为C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4 H2O(g),若0.1mol 偏二甲肼与N2O4完全反应时,放出 526.65kJ的热量,则1molC2H8N2完全燃烧放出5266.5 kJ,热化学方程式为C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4 H2O(g)△H=-5266.5 kJ•mol-1,
故答案为:C2H8N2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4 H2O(g)△H=-5266.5 kJ•mol-1.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析、计算能力,注意把握热化学方程式的书写以及盖斯定律的运用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 把过量新制的氯水滴加到石蕊试液中,溶液颜色先变蓝后褪色 | |
| B. | 自来水厂用氯气给水消毒,是因为氯气与水反应生成的HClO具有强氧化性 | |
| C. | Cl2、Cl-均有毒 | |
| D. | Cl2、HClO、H2O2都具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液为澄清状态 | |
| B. | 反应后溶液中AlO2-浓度为0.1 mo L•L-1 | |
| C. | 反应后溶液中离子浓度最大的是Cl- | |
| D. | 溶液中Al3+与AlO2-浓度之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | Li | C | N | O | F | Ne | ||
| 三 | Na | Mg | S | Cl | ||||
| 四 | K | Ca | Br |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 试剂1 | 试剂2 | 操作及现象 |
| ① | 铜丝 | 氯气 | 将加热后的铜丝伸入盛有氯气的集气瓶中,产生棕黄色的烟 |
| ② | 稀硝酸 | 产生无色气体,遇空气变为红棕色 | |
| ③ | 0.1mol/LKMnO4溶液 | 加热后,铜丝表面有黑色物质,溶液颜色无明显变化 |
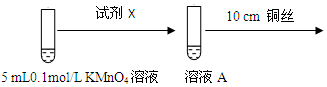
| 环境 | 反应现象 |
| 酸性 | 溶液紫红色变浅 |
| 碱性(1mL 1mol/L NaOH溶液) | 无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com