
��ʽ��������NiOOH�������������ص��������ϡ��Ժ�����Ni2������ҺΪԭ������NiOOH��һ�ֹ����������£�

��1������Na2CO3��Һʱ��ȷ��Ni2���Ѿ���ȫ������ʵ�鷽���� ��
��2����֪Ksp[Ni(OH)2]��2��10��15����ʹNiSO4��Һ�в���c(Ni2��)��2��10��5 mol��L��1������pH�ķ�Χ�� ��
��3��д���ڿ����м���Ni(OH)2��ȡNiOOH�Ļ�ѧ����ʽ�� ��
��4�������Ȳ���֣��Ƶõ�NiOOH�л����Ni(OH)2������ɿɱ�ʾΪxNiOOH��yNi(OH)2���ֳ�ȡ9.18 g��Ʒ����ϡ���ᣬ����100 mL 1.0 mol��L��1 Fe2������Һ����������Һ������������200 mL��ȡ��20.00 mL����0.010 mol��L��1 KMnO4����Һ�ζ�����ȥKMnO4����Һ20.00 mL����ͨ������ȷ��x��y��ֵ��д��������̣����漰��Ӧ���£���δ��ƽ����
NiOOH��Fe2����H����Ni2����Fe3����H2O Fe2����MnO4����H����Fe3����Mn2����H2O
 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
NA���������ӵ�����������������ȷ����
A��1 mol Cl2�ڷ�Ӧ�еõ���������һ��ΪNA
B��1 mol O2�ڷ�Ӧ�еõ�������һ��Ϊ4NA
C��1 molNa2O2������H2O��Ӧ��ת��2NA������
D����2KClO3+4HCl(Ũ)== 2KCl+2ClO2��+Cl2��+2H2O�У��������������������ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��98����Ũ����(�ܶ�Ϊ1��84g��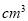 )����100inL 1 mol��L��ϡ���ᣬ�ָ�����������(���ƹ����п����õ�)����100mL��Ͳ ��10mL��Ͳ ��50mL�ձ� ��������ƽ ��100mL����ƿ ��ͷ�ι� �߲�������������ʹ���������Ⱥ�˳��������ȷ����
)����100inL 1 mol��L��ϡ���ᣬ�ָ�����������(���ƹ����п����õ�)����100mL��Ͳ ��10mL��Ͳ ��50mL�ձ� ��������ƽ ��100mL����ƿ ��ͷ�ι� �߲�������������ʹ���������Ⱥ�˳��������ȷ����
A���ܢۢߢݢ� B���ڢݢߢ� C���٢ۢݢޢ� D���ڢޢۢߢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ��ˮ�и�����ѧ�ڵ����β��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���и���������ָ����Һ�У�һ���ܴ����������
A������Mg�ܷų�H2����Һ�У�Mg2+��NH4+��Cl����SO42��
B������NaClO����Һ�У�K+�� Al3+��Br����S2��
C����������Һ��Cu2+��SO42����HCO3����H+
D��ʹ���ȱ�����Һ�У�Fe2+��MnO4����Na+��SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ�����и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
Cu2S��һ��Ũ�ȵ�HNO3��Ӧ������Cu(NO3)2��CuSO4��NO2��NO��H2O��������n(NO2)��n(NO)��1��1ʱ������˵����ȷ����
A��1 mol Cu2S�μӷ�Ӧʱ��8 mol����ת��
B���μӷ�Ӧ��n(Cu2S)��n(HNO3)��1��5
C����Ӧ��Cu2S������������������ԭ��
D������n[Cu(NO3)2] : n[CuSO4 ]=l:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�γ��и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
�������������һ���������ܼ�������������ܼ���ʵ�����Ʊ�������������ķ�Ӧԭ����ʵ��װ�ü�����������£�

| ���� | ��� �������� | �ܶ�/g��cm��3 | �е�/�� | ˮ�� �ܽ��� |
���� | 92 | 1.2636 | 290 ���ֽ⣩ | �� | |
���� | 60 | 1.0492 | 118 | �� | |
����������� | 218 | 1.1596 | 258 | ���� |
ʵ�鲽�裺
����1.��500mL��Ӧ���м���200g�����ᣬ92g���ͺ�100mL���������������������Ӳ��¶ȼƿڼ���3mLŨ����������Ȳ�����1h��ֹͣ���ȡ�
����2.��5%̼������Һϴ�ӣ�����ˮϴ�ӣ���������ˮ�Ȼ��ơ�
����3.�Ƚ��г�ѹ�����ռ�75��85����֡�
����4.����ѹ����ٽ��м�ѹ�����ռ�128��131��/933Pa��֣����յò�Ʒ176g��
��1������1�ȿ����������Ũ�����Ŀ���� �������������Ŀ���� ��
��2����5%̼������Һϴ�ӵ���ҪĿ���� ������ˮ�Ȼ��Ƶ�Ŀ���� ��
��3������ü�ѹ��������ó�ѹ������ԭ���� ��
��4������ʵ�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ�����и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ������
��10�֣���֪�����������������Һ�У���������ɫ���壬����Һ���Ϻ�ɫ��ȥ������һ��������ԭ��Ӧ����ϵ������KCl��Cl2��H2SO4��H2O��KMnO4��MnSO4��K2SO4�������ʣ�
��1���÷�Ӧ�У����ϼ����ߵķ�Ӧ����__________�����ϼ�û�з����仯�ķ�Ӧ����________________��
��2��д��һ�����������������ʵ�������ԭ��Ӧ����ʽ(����ƽ) _____________________��
��3��������Ӧ�У���������__________________��1 mol�������ڷ�Ӧ��________________(��õ�����ʧȥ��)______________mol���ӡ�
��4������ڷ�Ӧ�����Һ�м���NaBiO3����Һ�����Ϻ�ɫ��������˵��NaBiO3����ʲô���ʣ�___________________________��д���÷�Ӧ�����ӷ���ʽ ������ʾ��NaBiO3Ϊ��ɫ����ɫ��ĩ����������ˮ���ڸ÷�Ӧ��ת��ΪBi3+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�߰��и�����ѧ�ڵڶ��ζο���ѧ�Ծ��������棩 ���ͣ�ʵ����
���������һ����;�㷺��ǿ��������ʵ�����Ʊ�����������漰�Ļ�ѧ����ʽ���£�MnO2����������3MnO2+ KClO3+ 6KOH  3K2MnO4+ KCl+3H2O��
3K2MnO4+ KCl+3H2O��
K2MnO4�绯��3K2MnO4+ 2CO2��2KMnO4+ MnO2��+2K2CO3��
��֪K2MnO4��Һ����ɫ����ش��������⣺
��1��MnO2��������Ӧ���� �м��ȣ���������ţ���
���ձ� �ڴ����� �������� ��������
��2����MnO2�����������ò�����Ƚ�ȡҺ��ͨ��CO2���壬ʹK2MnO4�绯�Ĺ�������ͼװ���н��У�A��B��C��D��EΪ������F��GΪ���ң�HΪ���ܵIJ�������
��Ϊ���ܳ������CO2��װ����ʹ�����������ҡ����Թ������μ����״̼��ƺ�����ر�����B��E��������A��������C��D������K2MnO4��Һ��ͨ��CO2���壬δ��Ӧ��CO2���ռ�������F�С�������F�ռ����϶�����ʱ���ر����� �������� �����ἷѹ����F��ʹCO2���建����ѹ��K2MnO4��Һ���ٴη�Ӧ��δ��Ӧ��CO2�����ֱ��ռ�������G�С�Ȼ������G�е����強ѹ������F�У���˷�����ֱ��K2MnO4��ȫ��Ӧ��
�ڼ���K2MnO4�绯��ȫ��ʵ������� ��
��3������������ԭ�ζ������и�����ش��ȷ�����ԭ��Ϊ��
2MnO4��+5C2O42��+16H+=2Mn2++10CO2��+8H2O
�ֳ�ȡ�Ƶõĸ�����ز�Ʒ7.245g�����500mL��Һ������Һ����ȡ25.00 mL����Һ����0.1000 mol��L��1�����Ʊ���ҺҺ���еζ����յ�ʱ���ı�Һ���Ϊ50.00mL�����������ʵķ�Ӧ�����������ز�Ʒ�Ĵ���Ϊ ������4λ��Ч���֣���֪M(KMnO4)=158g��mol��1��������Һ��������ˮϴ����û���ô���Һ��ϴ���ɣ���ⶨ����� �����ƫ����ƫС���������䡱��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶������в��Ի�ѧ�Ծ��������棩 ���ͣ������
(10��)�����£���25mL 0.1mol/L MOH��Һ����μ���0.2mol/L HA��Һ��������ͼ��ʾ������仯���Բ��ƣ����ش��������⣺
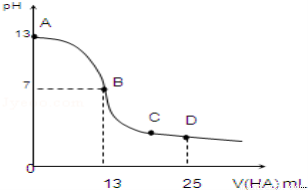
��1��д��MOH�ĵ��뷽��ʽ��__________________
��2��MOH��HAǡ����ȫ��Ӧʱ����Һ��________�ԣ���ᡱ��������С����������ǣ������ӷ���ʽ��ʾ����__________����ʱ�������Һ����ˮ�������c��H+��_________0.2mol/L HA��Һ����ˮ�������c��H+�����������������=������
��3��д��B�㣬�����Һ�и�����Ũ�ȵĴ�С��ϵB��____________.
��4��D��ʱ����Һ��c��A����+c��HA��__________2c��M+�������������������=����.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com