
| A. | 次氯酸 | B. | 浓硫酸 | C. | 氯水 | D. | 陶瓷 |
科目:高中化学 来源: 题型:解答题
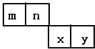 m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46,则: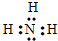 ,空间构型为三角锥形.
,空间构型为三角锥形.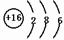 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
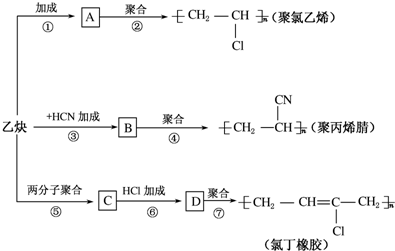

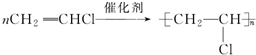 ;
;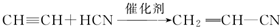 ;
;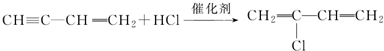 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:
在容积为2L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g)在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 解释 | |
| A | 100℃0.1mol/L Na2SO4溶液pH=6.2 | H2O=H++OH- |
| B | 0.1mol/L CH3COOH的pH=3 | CH3COOH?CH3COO-+H+ |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O?Fe(OH)3+3H+ |
| D | 随温度有升高,碳酸钠溶液pH增大 | CO32-+2H2O?H2CO3+2OH- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ①③④ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com