
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
(1)盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的
D
D

(2)配制稀硫酸时,还缺少的仪器有
100mL容量瓶、玻璃棒
100mL容量瓶、玻璃棒
(写仪器名称);
(3)经计算,配制100mL1mol?L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为
5.4
5.4
mL,量取硫酸时应选用
A
A
规格的量筒;
A.10mL B.50mL C.100mL D.200mL
(4)在烧杯中稀释浓硫酸的实验操作为
将浓硫酸沿烧杯壁缓缓注入装有水的烧杯中,并用玻璃棒不断搅拌,使产生的热迅速散去
将浓硫酸沿烧杯壁缓缓注入装有水的烧杯中,并用玻璃棒不断搅拌,使产生的热迅速散去
,若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为
立即用抹布擦去,用大量水冲洗,涂上3%~5%NaHCO3的稀溶液
立即用抹布擦去,用大量水冲洗,涂上3%~5%NaHCO3的稀溶液
.
(5)对所配制的稀硫酸进行测定,发现其浓度大于1mol?L-1,配制过程中下列各项操作可能引起该误差的原因
ACE
ACE
.
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E.定容时,俯视容量瓶刻度线进行定容
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.

 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )

 名校课堂系列答案
名校课堂系列答案 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
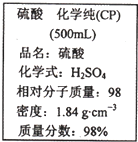 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )