
| A. | 肯定含有碳、氢、氧三种元素 | |
| B. | 肯定含有碳、氢元素,可能含有氧元素 | |
| C. | 肯定含有碳、氢元素,不含氧元素 | |
| D. | 该有机物是甲醇 |
分析 碱石灰增重的质量为二氧化碳,浓硫酸增重的质量为水,根据n=$\frac{m}{M}$计算出该有机物分子中含有C、H的物质的量,再根据m=nM计算出含有C、H元素的质量,结合该有机物总质量判断是否含有O元素,然后计算出含有O元素的物质的量,从而可确定其最简式,根据计算结果进行判断.
解答 解:3.2g该有机物在氧气中燃烧后生成的产物依次通过浓硫酸和碱石灰,分别增重3.6g和4.4g,则生成水的质量是3.6g,所以氢原子的物质的量是:$\frac{3.6g}{18g/mol}$×2=0.4mol,氢元素的质量为:1g/mol×0.4mol=0.4g;
生成的二氧化碳的质量是4.4g,碳原子的物质的量是:$\frac{4.4g}{44g/mol}$=0.1mol,含有碳元素的质量为:12g/mol×0.1mol=1.2g,
3.2g该有机物分子中含有C、H元素的总质量为:0.4g+1.2g=1.6g,说明该有机物分子中一定含有O元素,含有O的物质的量为:$\frac{3.2g-1.6g}{16g/mol}$=0.1mol,所以该有机物分子中含有C、H、O原子的物质的量之比=0.1mol:0.4mol:0.1mol=1:4:1,
A.根据分析可知,该有机物分子中含有碳、氢、氧三种元素,故A正确;
B.根据分析可知,该有机物分子中一定含有氧元素,故B错误;
C.该有机物分子中一定含有氧元素,故C错误;
D.该有机物的最简式为CH4O,由于H元素已经达到饱和,则该有机物一定为甲醇,故D正确;
故选AD.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,正确判断是否含有氧元素为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol/LAg+ | B. | 0.4mol/L Ba2+ | C. | 0.4mol/L Mg2+ | D. | 0.2mol/L CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8mL | B. | 2.4mL | C. | 3mL | D. | 4mL或1.2mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤(简述操作过程) | 预期现象和结论 |
| ① ② ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

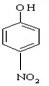 .
.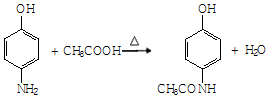 .
.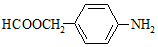 和
和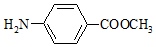 ,写出另3种同分异构体的结构简式
,写出另3种同分异构体的结构简式 、
、 、
、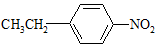 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com