
分析 处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、保里不相容原理和洪特规则,根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写,以此解答该题.
解答 解:(1)电负性最大的元素是氟,电子排布式为1s22s22p5,故答案为:1s22s22p5;
(2)自然界中含量居第二的金属元素为铁,电子排布式为1s22s22p63s23p63d64s2,故答案为:1s22s22p63s23p63d64s2;
(3)第四周期0族元素为Kr,电子排布式为1s22s22p63s23p63d104s24p6,故答案为:1s22s22p63s23p63d104s24p6;
(4)能形成自然界中最硬的单质的元素为碳,电子排布式为1s22s22p2,故答案为:1s22s22p2.
点评 本题考查了基态原子的核外电子排布式,根据核外电子排布规律来写,注意电子处于全满、半满、全空时最稳定,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | Y | ||
| Z | W | M |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:

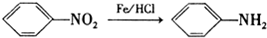

 .
. ,C中含有的含氧官能团的名称为硝基和羧基.
,C中含有的含氧官能团的名称为硝基和羧基. .
. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
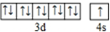 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
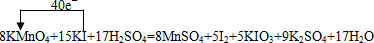
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3gNa在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6 L NH3中含有的氢原子数目为0.75NA | |
| C. | 1L0.1mol/LH3PO4溶液中含有的离子数目为0.4NA | |
| D. | 1个C02分子的质量为$\frac{44}{N_A}g$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com