
【题目】已知![]() 的
的![]() 室温下,
室温下,![]() 存在以下电离过程:
存在以下电离过程:![]() ;
;![]() ,
,![]() 下列相关叙述正确的是
下列相关叙述正确的是![]()
A.![]() 溶液和
溶液和![]() 溶液均显碱性
溶液均显碱性
B.![]() 的
的![]() 和
和![]() 溶液,后者水的电离程度大
溶液,后者水的电离程度大
C.![]() 溶液中滴加少量氨水的离子方程式:
溶液中滴加少量氨水的离子方程式:![]()
D.![]() 溶液中加入少量
溶液中加入少量![]() 的离子方程式为:
的离子方程式为:![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
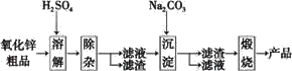
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:

(1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是_____。
(2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,还含有Fe2+、Cu2+等杂质。先加入____(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009mol·L-1,则每升溶液中至少应加入__molKMnO4。
(3)杂质Cu2+可利用置换反应除去,应选择的物质是_____。
(4)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450℃~500℃下进行,“煅烧”反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
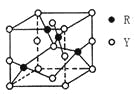
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将浓度均为0.1mol·L-1、体积分别为Va和Vb的HA 溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示,下列说法正确的是
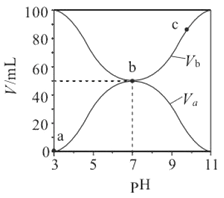
A. a→c 过程中水的电离程度始终增大
B. b点时,c(B+)=c(A-)=c(H+)=c(OH-)
C. c点时, 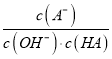 随温度升高而减小
随温度升高而减小
D. 相同温度下,Ka(HA)>Kb(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )
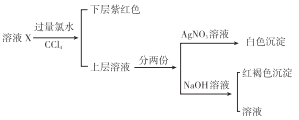
A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、1.01×105Pa下,将22gCO2通入750mL1molL-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知该条件下,将1molCO2通入1L2molL-1NaOH溶液中充分反应放出ykJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJmol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJmol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJmol-1
D.2CO2(g)+2NaOH(aq)=2NaHCO3(aq) ΔH=-(4x-2y)kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.熵减的吸热反应可能是自发反应
B.需要加热的化学反应,生成物的总能量一定高于反应物的总能量
C.使用催化剂既不会改变反应的限度又不会改变反应的焓变
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:
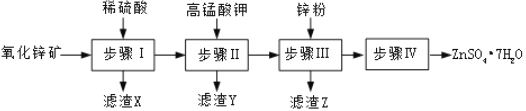
(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。
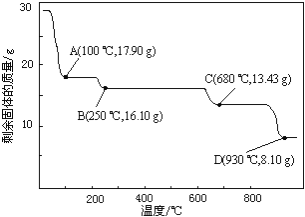
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.反应N2(g)+3H2(g)![]() 2NH3(g)的ΔH < 0,ΔS <0
2NH3(g)的ΔH < 0,ΔS <0
B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C.常温下,Ksp=5.6×1012,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×104 mol·L1
D.常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com