
(16分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).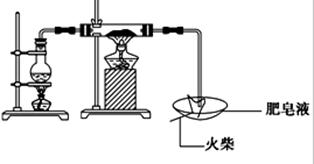
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| | 实验步骤 | 预期现象与结论 |
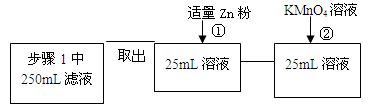
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的 ,振荡溶解,过滤后将滤液配成250mL溶液,待用。 | |
| 步骤2 | 取少量步骤1中滤液于试管中, | |
| 步骤3 | 取少量步骤1中滤液于试管中, | |
(1)将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱。(2分)
(2)3Fe+4H2O(g)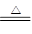 Fe3O4+4H2(2分)
Fe3O4+4H2(2分)
(3) 实验步骤 预期现象与结论 步骤1 3mol/L H2SO4(2分) 步骤2 滴加1~2滴20%KSCN(2分) 溶液变红色,则固体产物含+3价铁(1分) 步骤3 滴加1~2滴0.01mol/L KMnO4(2分) 溶液紫色褪去,则固体产物含+2价铁(1分)
除去反应后固体中可能未反应完的铁粉,以免影响后续实验的结果分析。
(4)将Fe3+还原为Fe2+ (2分)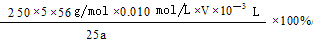 (2分)
(2分)
解析试题分析:
(1)检查装置的气密性有加热法和液压法,从本装置的情况看,应该选用加热法,注意操作要C处将导管伸入水槽,并微热A处圆底烧瓶,现象是导管末端出现气泡,停止加热后导管末端出现一段水柱,结论是气密性良好,用操作现象结论的思维进程去答题。
(2)书写这个方程式要注意金属和水反应的特点,如常见的Na、Mg、Al、Fe等金属与水的反应。
(3)验证固体产物中铁元素的价态 ,先要将固体溶解,但考虑到可能有铁单质剩余,会和三价铁离子反应,所以要先除去铁单质,选用的试剂是硫酸铜溶液,然然,剩余的固体则应用稀硫酸溶解(因为硝酸的氧化性会氧化二价铁),接着确定检验相应离子的试剂,三价铁离子用的是硫氰化钾溶液,而检验二价铁则从限选试剂中只能用高锰酸钾溶液,利用二价铁离子的还原性,答题时注意试剂的用量和叙述即可。
(4)弄清实验目的“固体产物中铁元素的质量分数的测定”,所以由加入锌粉后溶液的黄色恰好消失,可知是用于还原三价铁离子;由题意可知,n(Fe2+)=5n(MnO4-) m(Fe)=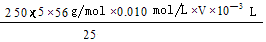 ,再求质量分数即可
,再求质量分数即可
考点:铁与水蒸气的反应;气密性的检验;实验方案设计;二价铁、三价铁离子的检验方法。


科目:高中化学 来源: 题型:填空题
微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石.矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用: 。
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe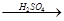 H2
H2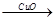 Cu ②CuO
Cu ②CuO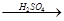 CuSO4
CuSO4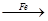 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将一小块金属钠投入到盛有100ml AlCl3和MgCl2的混合溶液的烧杯中,发现烧杯中有气泡产生,在这过程中还看到烧杯中有白色沉淀产生,沉淀物先多后少。反应完毕后,收集到标准状况下氢气13.44L同时得到21.4g沉淀,将沉淀溶于过量的NaOH溶液中,发现沉淀减少了15.6g,求原混合溶液中Mg2+、Al3+及Cl-的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2?A12O3?CaO?MgO等杂质)?用该烧渣制取药用辅料——红氧化铁的工艺流程如下: 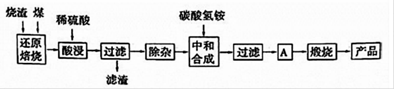
(1)在“还原焙烧”中产生的有毒气体可能有 ?
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中 含量将下降,其原因是 (用离子方程式表示)?
含量将下降,其原因是 (用离子方程式表示)?
(3)根据下表数据: 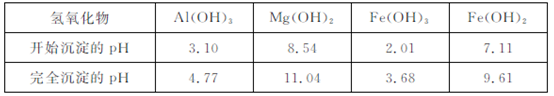
在“除杂”步骤中,为除去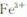 和
和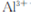 ,溶液的pH最大值应小于 ,常温下,当
,溶液的pH最大值应小于 ,常温下,当
pH="5" 时,溶液中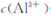 =
= 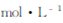 (已知常温下
(已知常温下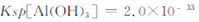 )?
)?
(4)“中和合成”的目的是将溶液中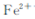 转变为碳酸亚铁沉淀,则A的操作是 ?
转变为碳酸亚铁沉淀,则A的操作是 ?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为 (填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是 和 (填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。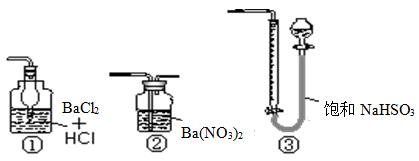
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。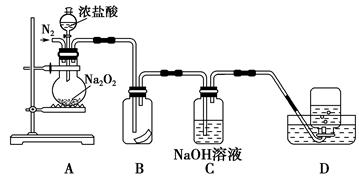
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;② 。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。 Na2O2+
Na2O2+ HCl=
HCl= Cl2+
Cl2+ NaCl+
NaCl+ 该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为了“探究铁及其化合物的氧化性或还原性”.
(1)实验前同学预测:Fe2+肯定既有还原性又有氧化性.你认为他预测的依据是:__
(2)甲同学欲用实验证明他的预测.实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L -lFeCl2溶液、KSCN溶液、新制氯水.
①若计划在0.1 mol·L-l FeCl2溶液中滴入新制氯水,探究Fe2+的还原性,你预计可能发生反应的离子方程式为
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+反应的产物的存在以获取证据.你认为可选_____滴入小明所得的混合液中,并通过溶液出现___色的现象,证明该同学的观点和实验方案都是正确的.
③对于证明Fe2+具有氧化性,该同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果锌粒逐渐变小.由此说明三种金属的还原性由强至弱的顺序为________.
(3)甲同学分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为该同学梳理相关问题:若Fe2+在反应中表现出氧化性应转化成______(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成_____.
②实际上Fe2+还原性较强,实验室的FeCl2溶液常因氧化而变质.除杂的方法是: ,相关反应的离子方程式:_____ .
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在实验室测定碳酸钠与碳酸氢钠的混合物中,碳酸钠的质量分数[用符号w(Na2CO3)表示],称取此混合物5.lg,溶于水中,配成250mL溶液。
a.(10分)方案一:沉淀法测w(Na2CO3)利用化学反应把HCO3-、CO32-完全转化为沉淀,称取沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选的试剂是___________ (填编号)。
| A.CaCl2 | B.MgSO4 | C..NaCI | D.Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质。
(1)步骤1所需玻璃仪器是______;步骤3的操作名称是______。
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠;
假设2:只含有___________;
假设3:氯化钠和氢氧化钠都含有。
(3)设计实验方案,进行实验。
限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液。回答下列问题:
①加入过量试剂A的名称是______。
②填写下表:
| 实验步骤 | 预期现象和结论 |
| 步骤4: | |
| 步骤5: | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com