
【题目】某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42﹣、CO32﹣ .
(1)为了进一步确认,对该溶液进行实验检测:
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 仔细观察坐标图 | 肯定无 | 肯定无该离子的理由 |
步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 | 肯定无该离子的理由 |
步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42﹣、H+;肯定无Ba2+ | 肯定有H+的理由 |
实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、、灼烧、在干燥器中冷却.
(2)原溶液中H+物质的量浓度为mol/L.
(3)向溶液中加入NaHCO3溶液,反应的离子方程式为: .
(4)若向 100mL 该溶液中加入 1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时加入的Ba(OH)2溶液体积为 L. 
【答案】
(1)CO32﹣;碳酸根离子和镁离子之间会反应;Fe3+;该离子为黄色;电荷守恒;洗涤
(2)1.2
(3)H++HCO3﹣=H2O+CO2↑
(4)0.1
【解析】解:(1)溶液中含有镁离子,所以一定不含CO32﹣ , 根据电荷守恒,阳离子正电荷浓度总和:1mol/L+0.5×2mol/L=2mol/L,该溶液呈无色、透明、均一状态,一定不含Fe3+ , 加入足量BaCl2溶液,生成23.3g即0.1mol白色沉淀硫酸钡,再加稀硝酸,沉淀不消失,一定含有硫酸根0.1mol,一定不含钡离子,阴离子负电荷总浓度3mol/L+0.1mol/L×2=3.2mol/L,所以一定含有氢离子,浓度是1.2mol/L,所以答案是:CO32﹣;碳酸根离子和镁离子之间会反应;Fe3+;该离子为黄色;电荷守恒;实验操作的步骤三中称量沉淀前的实验操作步骤有:过滤、洗涤、灼烧、在干燥器中冷却,所以答案是:洗涤;(2)原溶液中H+物质的量浓度为1.2mol/L,所以答案是:1.2;(3)溶液中含有氢离子,向溶液中加入NaHCO3溶液,反应的离子方程式为:H++HCO3﹣=H2O+CO2↑,所以答案是:H++HCO3﹣=H2O+CO2↑;(4)向100mL 该溶液中含有硫酸根0.1mol,向100mL该溶液中加入1mol/L 的 Ba(OH)2溶液,恰好沉淀完全时,加入的Ba(OH)2溶液物质的量是0.1mol,体积是 ![]() =0.1L,所以答案是:0.1.
=0.1L,所以答案是:0.1.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题.
(1)请写出该实验的实验步骤
①溶解 ②冷却 ③转移 ④⑤⑥摇匀
(2)现在已有下列仪器:托盘天平,烧杯,量筒,要完成本实验还需仪器为:、 .
(3)试分析下列操作对所配溶液的浓度有何影响(偏高、偏低或者无影响)及造成该影响的原因.
①容量瓶用蒸馏洗涤后残留有少量的水,对所配溶液浓度的影响 , 原因是:
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响 , 原因是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH3(C2H5)CHCH(CH3)2的系统命名为2—甲基—3—乙基丁烷
B. 苯甲酸的结构简式为![]()
C. 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车
D. C5H10的同分异构体中属于烯烃的有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中,反应![]()
![]() C分别在三种不同实验条件下进行,它们的起始状态均为:
C分别在三种不同实验条件下进行,它们的起始状态均为: ![]() 、
、![]() 、
、![]() 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )
。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是( )
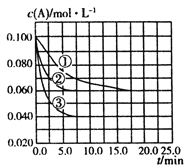
A. 反应的平衡常数:①<②
B. 反应A+2B![]() C的
C的![]()
C. 实验②平衡时B的转化率为60%
D. 实验③平衡时![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇-空气燃料电池(DMFC)是一种高效、轻污染的车载电池,其工作原理如图。 下列有关叙述正确的是( )

A. 该装置能将电能转化为化学能
B. 电子由甲电极经导线流向乙电极
C. 负极的电极反应式为:CH3OH+6OH--6e-![]() CO2+5H2O
CO2+5H2O
D. b口通入空气,c口通入甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法不正确的是( )
A.化学反应达到最大限度时,正逆反应速率也达到最大且相等
B.催化剂能降低化学反应的活化能,加快反应速率,提高生产效率
C.用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率
D.用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列内容与结论相对应的是
选项 | 内容 | 结论 |
A | H2O(g)变成H2O(l) | △S>0 |
B | 硝酸铵溶于水可自发进行 | 因为△S>0 |
C | 一个反应的△H>0,△S>0 | 反应一定不自发进行 |
D | H2(g)+F2(g)=2HF(g),△H=-271kJ/mol △S=8J/(mol·K) | 反应在任意外界条件下均可自发进行 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的性质比较,正确的是( )
A. 酸性HClO4>HBrO4>HIO4 B. 原子半径:H<Na<Mg<Al
C. 稳定性:HI>H2S> HCl D. 氧化性:Na+>Mg2+>Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com