
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO,反应物和产物的相关数据列表如下:
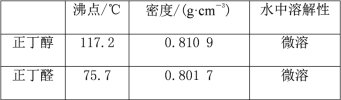
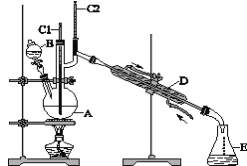
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,与5mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为__________。
(2)加入沸石的作用是_______________。 若加热后发现未加沸石,应采取的正确方法是_________。
(3)上述装置图中,D仪器的名称是______________,E仪器的名称是_______。
(4)分液漏斗使用前必须进行的操作是_________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______层(填“上”或“下”)。
(6)本实验中,正丁醛的产率为_______%(结果保留两位小数)。
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物分别溶于水得溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是( )

A.Y可能是硅元素
B.简单离子半径:Z>W>X
C.气态氢化物的稳定性:Y>W
D.非金属性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A在一定条件下可发生如图转化。
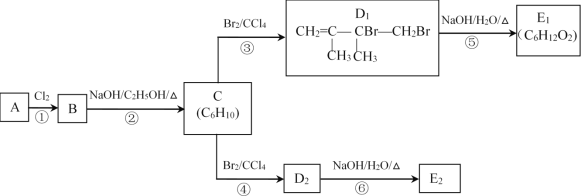
已知:A的质谱图表明其相对分子质量为84,其核磁共振氢谱只有一种氢。E1、E2互为同分异构体。
(1)D1是否存在顺反异构___(填“是”或“否”)。
(2)①至⑥的反应中,属于加成反应的是___。
(3)C的化学名称是___。
(4)写出A在一定条件下发生加聚反应的化学方程式___。
(5)E2的结构简式为___。
(6)写出反应②的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂,它能将工厂排放的CO)以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充有Na2CO3溶液,其原理如图所示。

(1)这种微胶囊吸收CO2的原理是 ____用离子方程式表示),此过程是_____填“吸收”或“放出”)能量的过程。
(2)在吸收过程中下列关于胶囊内溶液的说法正确的是 ___(填字母)。
a.吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b.吸收过程中,体系中的含碳微粒只有CO32-、HCO3-、H2CO3
c.当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d.溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将解吸后的CO2催化加氢可制取乙烯。
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H1=-1323kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1
2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H3=_______________
(4)在体积为2L的恒容容器中发生反应:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)。当投料为1 mol CO2(g)和3molH2 (g)时,测得温度对CO2平衡转化率的影响为曲线a,改变投料比![]() 测量后得到曲线b。
测量后得到曲线b。
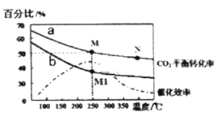
①根据曲线a计算250℃时该反应的化学平衡常数K= ____代入数值列出计算式即可)。
②b条件下投料比![]() ____(填“>” “<”或“=”)3,判断依据是 __ 。
____(填“>” “<”或“=”)3,判断依据是 __ 。
③下列说法正确的是 ___(填字母)。
A.平衡常数大小:M>N>M1
B.其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
C.当压强、混合气体的密度或![]() 不变时均可视为化学反应已达到平衡状态
不变时均可视为化学反应已达到平衡状态
D.工业生产中采取较高温度(250℃左右)是为了提高催化剂活性加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系一定正确的是( )
A.25℃时,pH均为10的氨水与 Ba(OH)2 溶液中,溶质的物质的量浓度之比为1:2
B.某温度下,0.1mol·L1 NaHCO3溶液的pH=8,则 c(OH)=106mol·L1
C.0.1mol·L1的HA溶液的pH=2,溶液中c(H+)=c(OH)+c(A)
D.pH=9的CH3COONa溶液与pH=9的氨水中,水电离出的c(OH)之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是___(填序号),抗酸药的成分Al(OH)3中和胃酸过多的离子方程式为___。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___(填序号,下同)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___。
(4)阿司匹林药品标签上贴有OTC,它表示___, 滥用药物会导致不良后果,如过量服用___会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中不能用勒夏特列原理解释的是
A.H2(g) + I2(g)![]() 2HI(g)平衡后增大压强颜色变深
2HI(g)平衡后增大压强颜色变深
B.Fe(SCN)3溶液中加入固体KSCN后颜色变深
C.N2 + 3H2![]() 2NH3 ΔH<0 工业上采用高温条件更有利于合成氨
2NH3 ΔH<0 工业上采用高温条件更有利于合成氨
D.向AgCl悬浊液中加入KI溶液,有黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,取10 mL 0.1 molL1某二元酸H2A,滴加0.1 molL1 NaOH溶液。已知:H2A=H+ + HA-,HA-![]() H+ + A2-。下列说法正确的是
H+ + A2-。下列说法正确的是
A.A2-可经过两步水解得到H2A
B.当用去NaOH溶液体积10 mL时,溶液中离子浓度大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当滴加至中性时,溶液中有c(Na+)=c(HA-) + c(A2-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=c(HA-) + c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
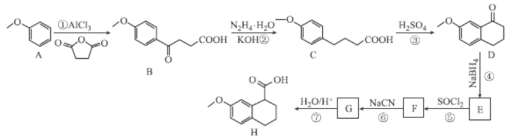
【题目】化合物H是C5a受体拮抗剂W-54011的中间体,Nakamura等人设计制备H的合成路线如图所示:
已知:Ⅰ.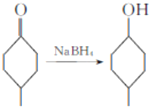 ;
;
Ⅱ.R-CN![]() R-COOH。
R-COOH。
回答下列问题:
(1)B中含氧官能团的名称为___。
(2)F的分子式为C13H13OCl,则F的结构简式为___。
(3)②⑤的反应类型分别为___、___。
(4)反应①的化学方程式为___。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,写出化合物H与足量H2发生加成反应的产物的结构简式___,并用星号(*)标出其中的手性碳:
(6)Q与C互为同分异构体,Q遇FeCl3溶液发生显色反应,且苯环上连有两个取代基,1molQ与足量NaHCO3溶液反应最多产生1molCO2,则Q的同分异构体有___种(不含立体异构)其中核磁共振氢谱有6组吸收峰的结构简式为___(任写一种)。
(7)参照上述合成路线和信息,设计以苯乙醛为原料(其它试剂任选),制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com