
科目:高中化学 来源: 题型:选择题
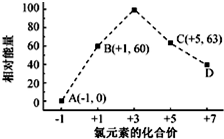
| A. | ③①④②⑤ | B. | ①③⑤④② | C. | ③②①⑤④ | D. | ⑤②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 食盐、食醋、食用油均可用作食品添加剂,都属于有机物 | |
| C. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用 | |
| D. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有②③ | C. | 只有①② | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.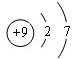 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 在标准状况下,22.4 LCH4与18 g H2O所含有的电子数均为10NA | |
| C. | 22.4 L CO气体与l molN2所含的电子数相等 | |
| D. | 1 mol HCl气体中的分子数与2L0.5 mo1/L盐酸中溶质分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 由N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ•mol-1热化学方程式可知,当反应中转移6NA电子 时,反应放出的热小于92.4 kJ | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
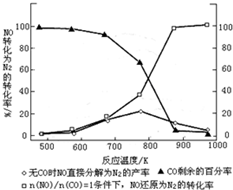 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com