
����Ŀ��ij�о���ѧϰС��Ϊ��̽������ĵ������������������ʵ�顣
ʵ��һ ���Ʋ��궨������Һ��Ũ��
ȡ����������250 mL 0.2 mol/L������Һ����0.2 mol/L�Ĵ�����Һϡ�ͳ�����Ũ�ȵ���Һ������NaOH����Һ�����������Һ��Ũ�Ƚ��б궨���ش��������⣺
��1������250 mL 0.2 mol/L������Һʱ��Ҫ�õ��IJ�����������Ͳ���ձ�������������ͷ�ιܺ� ��
��2��Ϊ�궨ij������Һ��ȷŨ�ȣ���0.2000 mol/L NaOH��Һ��20.00 mL������Һ���еζ�����̪��ָʾ���������εζ�����NaOH��Һ��������£�
ʵ����� | 1 | 2 | 3 | 4 |
����NaOH��Һ�������ml�� | 20.05 | 20.00 | 18.80 | 19.95 |
��ô�����Һ��ȷŨ��Ϊ mol/L��������С�������λ��
��3���жϵζ��յ�ķ����� ��
��4�����в����п���ʹ���������Һ��Ũ����ֵƫ�͵��� ������ĸ��ţ���
A����ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע���Һ
B���ζ�ǰʢ�Ŵ�����Һ����ƿ������ˮϴ����û�и���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
ʵ��� ̽��Ũ�ȶԴ������̶ȵ�Ӱ��
��pH�Ʋⶨ25��ʱ��ͬŨ�ȵĴ����pH��������£�
����Ũ�ȣ�mol��L��1�� | 0.0010 | 0.0100 | 0.0200 | 0.1000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 |
��5�����ݱ������ݣ����Եó�������������ʵĽ��ۣ�����Ϊ�ó��˽��۵������� ��
���𰸡�
��1��250ml����ƿ��
��2��0.2000mol��L��1��
��3���������һ�α���Һ����Һ��ɫ��dz��ɫ������Ӳ���ɫ��
��4��D��
��5��0.0100 mol��L��1 �����pH����2�����ϡ��10��ʱ��pH�ı仯ֵС��1��
��������
�����������1�����Ʋ����г������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡ�����ᣬ�ѱ����ᵹ���ձ������ܽ⣬��ȴ��ת�Ƶ�250mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ���������в��������ձ�����ͷ�ιܡ�250mL����ƿ����Ͳ���ʴ�Ϊ��250mL����ƿ��
��2������ʵ�������ĵ��������Ƶ�������������ϴ�����Ҫ��ȥ��V��NaOH��=![]() mL=20.00mL����c��CH3COOH��=
mL=20.00mL����c��CH3COOH��=![]() =
= ![]() =0.2000mol/L���ʴ�Ϊ��0.2000��
=0.2000mol/L���ʴ�Ϊ��0.2000��
��3���жϵζ��յ�ķ����ǵ������һ�α���Һ����Һ��ɫ��dz��ɫ���Ұ���Ӳ���ɫ���ʴ�Ϊ���������һ�α���Һ����Һ��ɫ��dz��ɫ���Ұ���Ӳ���ɫ��
��4��A����ʽ�ζ���δ�ñ�Һ��ϴ��ֱ��ע���Һ����Һ��Ũ��ƫС�����±�Һ�����ƫ����c�����⣩�T![]() ��������֪c�����⣩ƫ��A����B���ζ�ǰʢ�Ŵ�����Һ����ƿ������ˮϴ����û�и������Һ�����ʵ������䣬���±�Һ��������䣬���ݸ���c�����⣩�T
��������֪c�����⣩ƫ��A����B���ζ�ǰʢ�Ŵ�����Һ����ƿ������ˮϴ����û�и������Һ�����ʵ������䣬���±�Һ��������䣬���ݸ���c�����⣩�T![]() ��������֪c�����⣩���䣬��B����C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����±�Һ�����ƫ����c�����⣩�T
��������֪c�����⣩���䣬��B����C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����±�Һ�����ƫ����c�����⣩�T![]() ��������֪c�����⣩ƫ��C����D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���������Һ�����ʵ���ƫ���±�Һ�����ƫ���ݸ���c�����⣩�T
��������֪c�����⣩ƫ��C����D����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���������Һ�����ʵ���ƫ���±�Һ�����ƫ���ݸ���c�����⣩�T![]() ��������֪c�����⣩ƫ��D��ȷ����ѡD��
��������֪c�����⣩ƫ��D��ȷ����ѡD��
��5�������Ŀ���ÿ�β���ֵ��H+Ũ��ԶС�ڴ����Ũ�ȣ�˵�������ȫ���룻��ϵ��������Ũ��Ϊ0.100 0molL-1��0.0100molL-1��0.0010molL-1�Ĵ��ᣬpH�仯ֵС��1�����Դ�����������ʣ��ʴ�Ϊ��0.0100molL-1�����pH����2�����ϡ��10��ʱ��pH�ı仯ֵС��1��


 ����С״Ԫ��������������ϵ�д�
����С״Ԫ��������������ϵ�д� ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ԫ��X����ԭ�ӵĵ��Ӳ���Ϊn������������Ϊ2n+1�������й�Ԫ��X��˵���������
A. Ԫ��X�������ǽ���Ԫ��
B. Ԫ��X����̬�⻯�ﲻһ���ǵ����
C. Ԫ��X �������γɻ�ѧʽΪKXO3�ĺ��������
D. ��ҵ����ȡX�ĵ���ʱһ������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤������,����˵������ȷ����
A�����³�ѹ��,28gCO��N2��������к��е�ԭ������Ϊ2![]()
B����״����,11.2L��ˮ�к���ˮ����0.5NA
C��2molOH-�е�����Ϊ20NA
D��0.1molFeCl3�γ�Fe��OH��3���壬Fe��OH��3��������ĿС��0.1![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������ѧ��Ӧ����ͬһ��Ӧ���͵��ǣ� ��
A. ����ϩ�� 1��2-�������飻��������һ������
B. �ɱ����屽�����Ҵ������ᷴӦ����������
C. ��ϩʹ��ˮ��ɫ����ϩʹ���Ը��������Һ��ɫ
D. �ɱ������������ɱ��ƻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��̽��SO2���廹ԭFe3��������ʹ�õ�ҩƷ��װ������ͼ��ʾ������˵������������

A���ܱ���I���Ļ�ԭ������SO2��������B����ɫ��Һ��ɫ
B��װ��C������������SO2β������ֹ��Ⱦ����
C��Ϊ����֤A�з�����������ԭ��Ӧ��������ϡ�����ữ��BaCl2��Һ��������ɫ����
D��Ϊ����֤A�з�����������ԭ��Ӧ������KMnO4��Һ���Ϻ�ɫ��ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������������е�һԪӲ�Ҳ���Ϊ��о�����������������յĵ��ԭ��������Ϊ��Ӳ������ʱ����оӦ���� ��
A. ���� B. ���� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ�У���ȷ����
A�������ȼ������H=��890.3kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H=��890.3kJ/mol
B��һ�������£���0.5molN2��1.5molH2�����ܱ������г�ַ�Ӧ����NH3����akJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g) ![]() 2NH3(g) ��H=��2akJ/mol
2NH3(g) ��H=��2akJ/mol
C����101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(l) ��H=��571.6kJ/mol
D��HCl��NaOH��Ӧ���к�����H=��57.3kJ/mol����H2SO4��Ba(OH)2��Ӧ���к�����H=��114.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������λ��ͬһ���壬���ǿ����γ�������ɺ��������ƵĻ����һ������þ����Mg2B2O5��H2O����ȡ������Ĺ�������ͼ���£�
�ش��������⣺
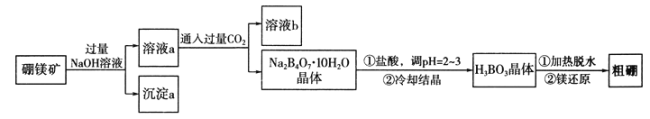
��1��Mg2B2O5��H2O��B�Ļ��ϼ�Ϊ____________��
��2����Һb�����ʵĻ�ѧʽΪ______________________��
��3����pH��ֽ����ҺpH�IJ���������________________________��
��4��д��Na2B4O7��10H2O�����ᷴӦ�Ļ�ѧ����ʽ��_____________________��
��5���ƵõĴ�����һ������������BI3��BI3���ȷֽ���Եõ������ĵ������ֽ�0.0200 g�����Ƴɵ�BI3��ȫ�ֽ⣬���ɵ�I2��0.3000 mo1��L-1Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��Һ15.00 mL������֪��I2+2S2O32-=2I-+S4O62-��
���ζ�������ָʾ��ͨ��Ϊ______________��
���ô�����Ʒ�Ĵ���Ϊ___________________��
�����ζ�����ʹ��ǰδ��Na2S2O3����Һ��ϴ�������Ʒ�Ĵ��Ƚ�_________������ƫ��������ƫ����������Ӱ��������
��6���������ͼ��ʽ��ƴӳ���a�л�õ���Mg������ͼ����ʾ���ڼ�ͷ�Ϸ����·���������Լ���ʵ���������
![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʣ���������ʯī���۰�ˮ���ܾƾ�����̼�����ƹ��壻���������ߴ����������������Һ�����Ȼ������壻�����ᡣ
��1���������ڷǵ���ʵ��ǣ�����ǿ����ʵ��ǣ�����������ʵ��ǡ�
��2��д������ˮ��Һ�еĵ��뷽��ʽ��
��3��д�����ʢݺ͢���ˮ�з�Ӧ�����ӷ���ʽ��
��4��д����͢���Һ��Ӧ�����ӷ���ʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com