
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为____________,基态镍原子中核外电子占据最高能层的符号为_____________.
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子__________________________________________________________(任写一种).
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)______,理由是_______________________________________________________________.
(4)H2S的键角__________(填“大于”“小于””等于”)H2O的键角,请从电负性的角度说明理由___________________________________________________.
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为_________g/cm3(只列出计算式).

【答案】![]() N分子晶体sp3杂化CN- 或C22-H2SeO4>H2SeO3(1分),因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离小于氧元素的电负性比硫元素更强,对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大正八面体
N分子晶体sp3杂化CN- 或C22-H2SeO4>H2SeO3(1分),因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离小于氧元素的电负性比硫元素更强,对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大正八面体![]() 或
或![]()
【解析】
(1)S位于周期表中第3周期第ⅥA族,基态硫原子的价电子排布式为3s23p4,则基态硫原子价层电子的轨道表达式(电子排布图)为:![]() ,Ni位于周期表中第4周期第ⅤⅢ族,基态Ni核外电子占据最高能层为N,故答案为:
,Ni位于周期表中第4周期第ⅤⅢ族,基态Ni核外电子占据最高能层为N,故答案为:![]() ;N;
;N;
(2)根据相似相溶原理判断,Ni(CO)4溶于乙醇、CCl4、苯等有机溶剂,所以可判断Ni(CO)4为分子晶体,Ni(CO)4空间构型与甲烷相同,甲烷为正四面体,中心C原子为sp3杂化,所以可判断中心原子的杂化轨道类型为sp3,等电子体是指原子总数相同,价电子总数相同的微粒,Ni(CO)4的配位为CO,O可用N-或者C2-代替,所以形成的等电子体可以为:CN-或C22-,故答案为:分子晶体;sp3;CN-或C22-;
(3)与硫同族的硒元素有两种常见的二元含氧酸,分别为H2SeO4和H2SeO3,酸性强弱H2SeO4>H2SeO3,理由为:因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离,故答案为:H2SeO4>H2SeO3;因为H2SeO4中非羟基氧数目比H2SeO3多,导致H2SeO4中Se元素的正电性更高,对羟基中共用电子对的吸引能力更强,使得羟基氢更易电离;
(4)根据价层电子对互斥理论,孤电子对存在可使键角变小,电负性O大于S,对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大,故答案为:小于;氧元素的电负性比硫元素更强,对键合电子的吸引力更强,键合电子之间的排斥力更大,所以键角更大;
(5)根据晶胞结构分析,阴离子采取面心立方堆积,形成八面体空隙和四面体空隙,但Ni2+填充在八面体空隙,由于阴离子是面心立方堆积,所以晶胞边长为a=2r(Ni2+)+2r(O2-)=418nm,不妨取1mol这样的晶胞,即有NA个这样的晶胞,则晶体密度为ρ=![]() =
=![]() g/cm3,故答案为:正八面体;
g/cm3,故答案为:正八面体;![]() 。
。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下面为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面(____)
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水(____)
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
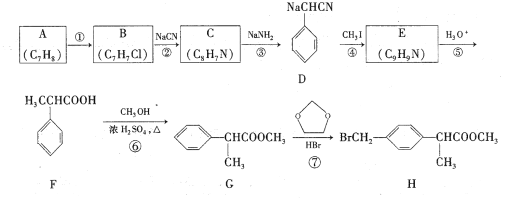
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”常用于去除或分离气流中的二氧化碳。
Ⅰ.2017年,中国科学家在利用二氧化碳直接制备液体燃料领域取得了突破性进展,其中用二氧化碳制备甲醇(CH3OH)的反应如下图:
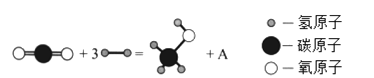
(1)A的化学式为_________。
(2)该反应说明CO2具有___________性(填“氧化”或“还原”)。若有1mol甲醇生成,转移电子的物质的量为_________________mol。
Ⅱ.利用NaOH溶液“捕提"CO2的基本过程如下图(部分条件及物质已略去):
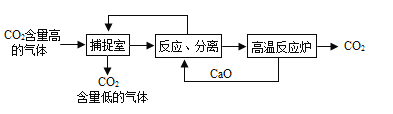
(1)反应分离室中,发生反应的化学方程式分别为CaO+H2O=Ca(OH)2和__________________
(2)高温反应炉中,涉及反应的化学反应类型为_______________________。
(3)整个过程中,可以循环利用物质的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液的正常pH约为7.35~7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO3-![]() H2CO3
H2CO3![]() CO2+H2O
CO2+H2O
H++PO43-![]() HPO42-
HPO42-
H++HPO42-![]() H2PO4-
H2PO4-
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人在静脉滴注的大量生理盐水后,血液被稀释,会导致c(H+)显著减少,pH值显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH值略减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有机物M的合成路线如下图:
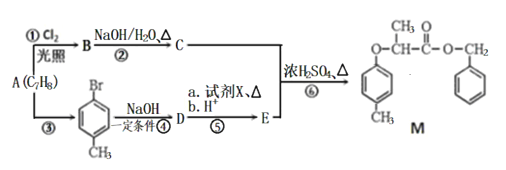
已知:i: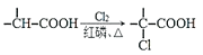 ii:
ii: 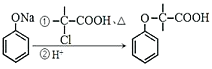
(1)M中含氧官能团的名称有醚键和___________,C的名称为___________,步骤⑥的反应类型为___________。
(2)步骤④反应的化学方程式为_________________________________。
(3)试剂X的结构简式为___________。
(4)同时满足下列条件,E的同分异构体有__________种。
I.能与FeCl3溶液发生显色反应;II.能发生水解反应和银镜反应;III.苯环上只有两个取代基。
其中核磁共振氢谱峰面积比为1:1:2:2:6的分子的结构简式为: ______________________。
(5)根据以上信息,写出以![]() 为原料制取
为原料制取 的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2
的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据题目要求回答下列问题。
(1)常温下,浓度均为0.lmol·L-1的下列六种溶液的pH如下表:
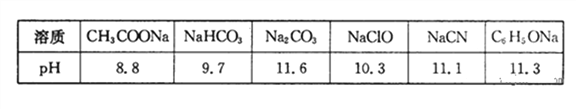
①上述盐溶液中的阴离子,结合H+能力最强的是______
②根据表中数据,浓度均为0.0lmol·L-1的下列五种物质的溶液中,酸性最强的是______(填编号);将各溶液分别稀释100倍,pH变化最小的是______(填编号)
![]()
③据上表数据,请你判断下列反应不能成立的是______(填编号)
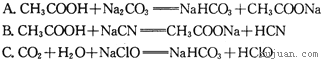
![]()
(2)已知常温下![]() ,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于______.
,又知常温下某CuSO4溶液里c(Cu2+)=0.02mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于______.
(3)已知可逆反应![]() 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
 ①写出该反应平衡常数的表达式:______
①写出该反应平衡常数的表达式:______
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件:升高温度,混合气体的密度______(选填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中含有 Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。据此分析,下列说法正确的是( )
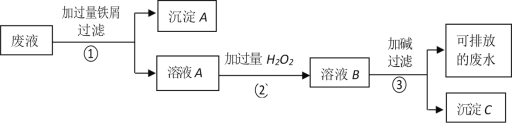
A. 沉淀 A 中含有 2 种金属单质
B. 可用 KSCN 溶液来检验溶液 B 中所含的金属离子
C. 溶液 A 若只经过操作③最终将无法得到沉淀 C
D. 操作①②③中都需要用到玻璃棒、漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com