
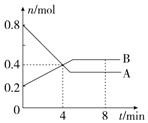
 ¢ń£®Ä³ĪĀ¶ČŹ±£¬ŌŚ2LČŻĘ÷ÖŠ£¬Ä³Ņ»»Æѧ·“Ó¦ÖŠA”¢BµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£¬ÓÉĶ¼ÖŠŹż¾Ż·ÖĪöµĆ£ŗ
¢ń£®Ä³ĪĀ¶ČŹ±£¬ŌŚ2LČŻĘ÷ÖŠ£¬Ä³Ņ»»Æѧ·“Ó¦ÖŠA”¢BµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆµÄĒśĻßČēĶ¼ĖłŹ¾£¬ÓÉĶ¼ÖŠŹż¾Ż·ÖĪöµĆ£ŗ·ÖĪö ¢ń£®£Ø1£©øł¾ŻĶ¼ĻóæÉÖŖ£¬ŌŚ4minÄ©Ź±£¬A”¢BµÄĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.2mol/L£¬“Ó0”«4minÄŚA”¢BµÄĪļÖŹµÄĮæÅØ¶Č±ä»ÆĮæ”÷c£ØA£©=0.4mol/L-0.2mol/L=0.2mol/L£¬”÷c£ØB£©=0.2mol/L-0.1mol/L=0.1mol/L£¬¾Ż“ĖÅŠ¶Ļ£»
£Ø2£©øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖć·“Ó¦ĖŁĀŹ£»
£Ø3£©øł¾Ż²Ī¼Ó·“Ó¦µÄĪļÖŹµÄĪļÖŹµÄĮæÅØ¶Č±ä»ÆÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±ČŹéŠ“»Æѧ·½³ĢŹ½£»
¢ņ£®ĻČÉčA”¢BµÄĪļÖŹµÄĮæĪŖnmol£¬øł¾ŻDµÄÅØ¶Č¼ĘĖćDµÄĪļÖŹµÄĮ棬øł¾ŻDµÄĪļÖŹµÄĮæ¼ĘĖć·“Ó¦5minŹ±A”¢BµÄĪļÖŹµÄĮ棬øł¾Ż5minŹ±£¬A”¢BÅضČÖ®±ČĒó³öA”¢BæŖŹ¼Ź±µÄĪļÖŹµÄĮ棬ŌŁøł¾ŻĪļÖŹµÄĮæÅØ¶Č¹«Ź½¼ĘĖćÅØ¶Č£»·“Ó¦ĖŁĀŹÖ®±Č¼“ĪŖ¼ĘĮæŹżÖ®±Č£¬øł¾ŻCµÄ·“Ó¦ĖŁĀŹĒóBµÄ·“Ó¦ĖŁĀŹ£¬øł¾ŻAµÄ×Ŗ»Æ¼ĘĖćAµÄ×Ŗ»ÆĀŹ£®
½ā“š ½ā£ŗ¢ń£®£Ø1£©øł¾ŻĶ¼ĻóæÉÖŖ£¬ŌŚ4minÄ©Ź±£¬A”¢BµÄĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.2mol/L£¬“Ó0”«4minÄŚA”¢BµÄĪļÖŹµÄĮæÅØ¶Č±ä»ÆĮæ”÷c£ØA£©=0.4mol/L-0.2mol/L=0.2mol/L£¬”÷c£ØB£©=0.2mol/L-0.1mol/L=0.1mol/L£¬¹Ź”÷c£ØA£©£¾”÷c£ØB£©£¬¹Ź“š°øĪŖ£ŗ=£»£¾£»
£Ø2£©·“Ó¦æŖŹ¼ÖĮ4minŹ±£¬AµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ£ŗv=$\frac{”÷c}{”÷t}$=$\frac{0.4mol/L-0.2mol/L}{4min}$ØT0.05mol/£ØL•min£©£¬
¹Ź“š°øĪŖ£ŗ0.05mol/£ØL•min£©£»
£Ø3£©ÓÉĶ¼ĻóæÉÖŖ£¬AµÄĪļÖŹµÄĮæÖš½„¼õŠ”£¬Ó¦ĪŖ·“Ó¦Īļ£¬BµÄĪļÖŹµÄĮæÖš½„Ōö¼Ó£¬Ó¦ĪŖÉś³ÉĪļ£¬²Ī¼Ó·“Ó¦µÄĪļÖŹµÄĪļÖŹµÄĮæÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£¬
Ōņn£ØA£©£ŗn£ØB£©=£Ø0.8mol-0.4mol£©£ŗ£Ø0.4mol-0.2mol£©=2£ŗ1£¬ĖłŅŌ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2A?B£¬¹Ź“š°øĪŖ£ŗ2A?B£»
¢ņ£®DµÄÅضČĪŖ0.5mol/L£¬ĖłŅŌDµÄĪļÖŹµÄĮæĪŖ0.5mol/L”Į2L=1mol
ÉčA”¢BµÄĪļÖŹµÄĮæĪŖnmol£¬
3A£Øg£©+B£Øg£©=xC£Øg£©+2D£Øg£©£¬
æŖŹ¼ n mol n mol 0 0
·“Ó¦ 1.5mol 0.5mol 1mol
5min £Øn-1.5£©mol £Ø n-0.5£©mol 1mol
Ķ¬Ņ»ČŻĘ÷ÖŠ£¬c£ØA£©£ŗc£ØB£©=n£ØA£©£ŗn£ØB£©=$\frac{n-1.5}{n-0.5}$=$\frac{3}{5}$£»n=3mol£»
£Ø1£©DµÄÅضČĪŖ0.5mol/L£¬·“Ó¦Ź±¼äĪŖ5min£¬DµÄ·“Ó¦ĖŁĀŹĪŖ$\frac{0.5mol/L}{5min}$=0.1mol/£ØL•min£©£¬CµÄ·“Ó¦ĖŁĀŹŹĒ0.1mol/£ØL•min£©£¬øł¾ŻĶ¬Ņ»·“Ó¦ÖŠ£¬ø÷ĪļÖŹµÄ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌx=2£¬¹Ź“š°øĪŖ£ŗ2£»
£Ø2£©CµÄ·“Ó¦ĖŁĀŹŹĒ0.1mol/£ØL•min£©£¬øł¾ŻĶ¬Ņ»·“Ó¦ÖŠ£¬ø÷ĪļÖŹµÄ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌBµÄ·“Ó¦ĖŁĀŹŹĒ$\frac{1}{2}$”Į0.1mol/£ØL•min£©=0.05mol/£ØL•min£©£»AµÄ×Ŗ»ÆĀŹĪŖ£ŗ$\frac{1.5mol}{3mol}$”Į100%=50%£»
¹Ź“š°øĪŖ£ŗ0.05mol/£ØL•min£©£»50%£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·“Ó¦ĖŁĀŹ±ä»ÆĒśĻß¼°Ó¦ÓĆŗĶ»ÆŃ§Ę½ŗāµÄÓŠ¹Ų¼ĘĖć£¬ĢāÄæÄŃ¶Č²»“ó£¬×¢Ņā·ÖĪöĶ¼ĻóĒśĻߵıä»ÆĒ÷ŹĘŅŌ¼°øł¾Ż·“Ó¦ĪļµÄĪļÖŹµÄĮæ¹ŲĻµŌĖÓĆČż¶ĪŹ½·Ø¼ĘĖćĘ½ŗāŹ±µÄĪļÖŹµÄĮæŹĒ½ā“šøĆĢāµÄ¹Ų¼ü£¬×¢ŅāĶ¬Ņ»·“Ó¦ÖŠ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ»Æѧ¼ĘĮæŹżÖ®±Č£®


 100·Ö“³¹ŲĘŚÄ©³å“ĢĻµĮŠ“š°ø
100·Ö“³¹ŲĘŚÄ©³å“ĢĻµĮŠ“š°ø ĆūŠ£ĮŖĆĖæģĄÖæĪĢĆĻµĮŠ“š°ø
ĆūŠ£ĮŖĆĖæģĄÖæĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
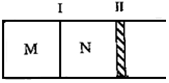 ČēĶ¼ĖłŹ¾øō°å¢ń¹Ģ¶Ø²»¶Æ£¬»īČū¢ņæÉ×ŌÓÉŅĘ¶Æ£¬M”¢NĮ½øöČŻĘ÷ÖŠ¾ł·¢ÉśČēĻĀ·“Ó¦£ŗA£Øg£©+3B£Øg£©?2C£Øg£©”÷H=-192kJ•mol-1£®³õŹ¼M”¢NČŻ»żĻąĶ¬£¬±£³ÖĪĀ¶Č²»±ä£¬ĻņM”¢NÖŠ·Ö±šĶØČėx mol AŗĶy mol BµÄ»ģŗĻĘųĢ壮ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼ĖłŹ¾øō°å¢ń¹Ģ¶Ø²»¶Æ£¬»īČū¢ņæÉ×ŌÓÉŅĘ¶Æ£¬M”¢NĮ½øöČŻĘ÷ÖŠ¾ł·¢ÉśČēĻĀ·“Ó¦£ŗA£Øg£©+3B£Øg£©?2C£Øg£©”÷H=-192kJ•mol-1£®³õŹ¼M”¢NČŻ»żĻąĶ¬£¬±£³ÖĪĀ¶Č²»±ä£¬ĻņM”¢NÖŠ·Ö±šĶØČėx mol AŗĶy mol BµÄ»ģŗĻĘųĢ壮ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ČōĘ½ŗāŹ±AĘųĢåŌŚĮ½ČŻĘ÷ÖŠµÄĢå»ż·ÖŹżĻąµČ£¬ŌņxŅ»¶ØµČÓŚy | |
| B£® | Čōx£ŗy=1£ŗ2£¬ŌņĘ½ŗāŹ±£¬MÖŠµÄ×Ŗ»ÆĀŹ£ŗA£¼B | |
| C£® | Čōx£ŗy=1£ŗ3£¬µ±MÖŠ·Å³öČČĮæ172.8 kJŹ±£¬AµÄ×Ŗ»ÆĀŹĪŖ90% | |
| D£® | Čōx=1.4£¬y=1£¬NÖŠ“ļµ½Ę½ŗāŹ±Ģå»żĪŖ2L£¬CĪŖ0.4mol£¬Ōņ·“ӦʚŹ¼Ź±MµÄĢå»żĪŖ2.4L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µ„ÖŹµā | B£® | Įņ»ÆĒā | C£® | ĀČ»ÆĆ¾ | D£® | ĒāŃõ»ÆÄĘ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Įņ-µāŃ»··Ö½āĖ®ÖĘĒāÖ÷ŅŖÉę¼°ĻĀĮŠ·“Ó¦£ŗ
Įņ-µāŃ»··Ö½āĖ®ÖĘĒāÖ÷ŅŖÉę¼°ĻĀĮŠ·“Ó¦£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ĪļÖŹ | Fe£ØOH£©2 | Cu£ØOH£©2 | Fe£ØOH£©3 |
| Ksp/25”ę | 8.0”Į10-16 | 2.2”Į10-20 | 4.0”Į10-38 |
| ĶźČ«³ĮµķŹ±µÄpH·¶Ī§ | ”Ż9.6 | ”Ż6.4 | 3”«4 |
| A£® | ĻņøĆ»ģŗĻČÜŅŗÖŠ¼ÓČėÉŁĮæĢś·Ū¼“ÄܹŪ²ģµ½ŗģÉ«¹ĢĢåĪö³ö | |
| B£® | ĻņøĆ»ģŗĻČÜŅŗÖŠÖšµĪ¼ÓČėNaOHČÜŅŗ£¬×īĻČ擵½Ą¶É«³Įµķ | |
| C£® | øĆ»ģŗĻČÜŅŗÖŠc£ØSO42-£©£ŗ{c£ØCu2+£©+c£ØFe2+£©+c£ØFe3+£©}£¾5£ŗ4 | |
| D£® | ĻņøĆ»ģŗĻČÜŅŗÖŠ¼ÓČėŹŹĮæĀČĖ®£¬²¢µ÷½ŚpHĪŖ3”«4£¬Č»ŗó¹żĀĖ£¬æɵƵ½“æ¾»µÄCuSO4ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 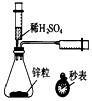 ²ā¶ØŅ»¶ØŹ±¼äÄŚÉś³ÉH2µÄ·“Ó¦ĖŁĀŹ | B£® | 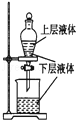 ĢįČ”ŗ£“ųÖŠµÄµā | ||
| C£® | 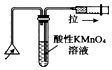 ¼ģŃ黚²ńČ¼ÉÕ²śÉśµÄSO2 | D£® | 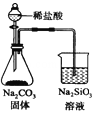 Ö¤Ć÷·Ē½šŹōŠŌ£ŗCl£¾C£¾Si |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢåŌŚŃõĘųÖŠ·Ö±šĶźČ«Č¼ÉÕ£¬·Å³öČČĮæŅ»Ńł¶ą | |
| B£® | ŠčŅŖ¼ÓČČ²ÅÄÜ·¢ÉśµÄ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦ | |
| C£® | ŌŚ101kpaŹ±£¬2gH2ĶźČ«Č¼ÉÕ£¬Éś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8kJČČĮ棬ŌņĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ£ŗ2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=-285.8kJ/mol | |
| D£® | ŌŚĒæĖįĒæ¼īĻ”ČÜŅŗÖŠ£ŗH+£Øaq£©+OH-£Øaq£©=H2O£Øl£©”÷H=-57.3kJ/mol£¬Čō½«ŗ¬1molNaOHµÄČÜŅŗŗĶŗ¬0.5molH2SO4µÄÅØĮņĖį»ģŗĻ£¬·Å³öµÄČČĮæ“óÓŚ57.3 kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Fe2+ | Fe3+ | Cu2+ | |
| æŖŹ¼³ĮµķŹ±pH | |||
| ĶźČ«³ĮµķŹ±pH | 8 | 3.2 | 6.7 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com