
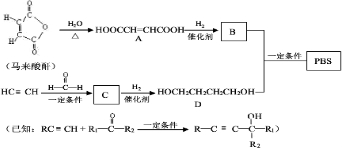


| 一定条件 |
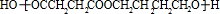 +(2n-1)H2O
+(2n-1)H2O| 一定条件 |
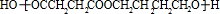 +(2n-1)H2O
+(2n-1)H2O ,故答案为:
,故答案为: ;
;| 一定条件 |
 +(2n-1)H2O,
+(2n-1)H2O,| 一定条件 |
 +(2n-1)H2O;
+(2n-1)H2O;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 0.64V |
| w |
| 0.64V |
| w |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
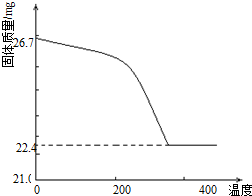 (2012?安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(2012?安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.| [SO42-] |
| [CO32-] |
| [SO42-] |
| [CO32-] |
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取一定量样品充分干燥,… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com