
| A. | 高温下焦炭还原二氧化硅制得粗硅 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 可用CO高温下还原赤铁矿炼铁 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
分析 A、工业上用碳还原二氧化硅反应生成硅和一氧化碳;
B、钠易和水反应生成氢氧化钠和氢气,所以该反应不能在水溶液中进行;
C.高温下CO还原赤铁矿氧化铁可以得到金属铁和二氧化碳;
D、制玻璃的原料是:石灰石、纯碱、石英.
解答 解:A、工业上用碳还原二氧化硅的办法来获得粗硅,故A正确;
B、钠易和水反应生成氢氧化钠和氢气,所以该反应不能在水溶液中进行,只能在熔融状态下发生置换反应,故B错误;
C.高温下CO还原赤铁矿氧化铁可以得到金属铁,此方法用于炼铁,故C正确;
D、制玻璃的原料是:石灰石、纯碱、石英,三者在玻璃熔炉中高温熔融可制得玻璃,故D正确;
故选B.
点评 本题综合考查学生物质的性质以及应用方面的知识,注意知识的归纳和梳理是关键,难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | c(H+)=1×10-1 mol•L-1的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 CH3COONa溶液:H+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y>Q | |
| B. | Q分别与X、Z形成的最简单化合物中化学键类型相同 | |
| C. | YW能与WQ发生复分解反应 | |
| D. | 最简单气态氢化物的稳定性:X<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “酸雨”、“温室效应”的形成都与化石燃料的燃烧有关 | |
| B. | NaHCO3是焙制糕点所用的发酵粉的主要成分之一 | |
| C. | 氢氧化铁胶体具有吸附性,因而常用于净水 | |
| D. | 硫酸钡在医学上用作钡餐,Ba2+对人体无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2在Cl2中剧烈燃烧,发出黄色火焰,冒白烟 | |
| B. | SiO2的化学性质不活泼,不与任何酸发生反应 | |
| C. | 常温下,铝、铁遇浓硫酸会发生钝化反应 | |
| D. | 将氯气通入紫色石蕊试液中一些时间后,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A~I为中学化学中常见的物质,B、E、F为单质,且在常温下B是一种黄绿色有毒气体,E为紫红色金属,G为黑色固体.它们的相互转化关系如图所示(部分生成物未列出).请回答下列问题:
A~I为中学化学中常见的物质,B、E、F为单质,且在常温下B是一种黄绿色有毒气体,E为紫红色金属,G为黑色固体.它们的相互转化关系如图所示(部分生成物未列出).请回答下列问题: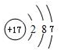 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
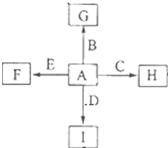 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

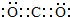 ;
; HClO+OH-;
HClO+OH-;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com