
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
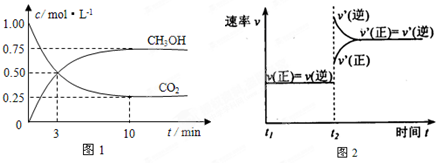
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol?L-1 | 0.44 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
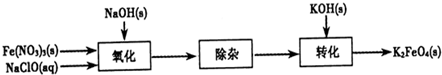
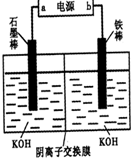
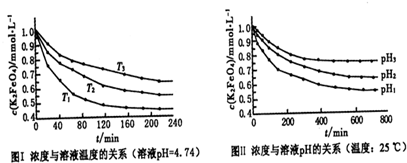
查看答案和解析>>
科目:高中化学 来源: 题型:
CuSO4·5H2O![]() CuSO4·3H2O
CuSO4·3H2O![]() CuSO4·H2O
CuSO4·H2O![]() CuSO4
CuSO4
某课外活动小组准备用浓硫酸和铜片为主要原料制取少量胆矾,其主要步骤有:①取少量铜片放在干燥的蒸发皿内,用酒精灯灼烧到其表面变黑为止;②向蒸发皿内加入一定量浓硫酸并加热,反应结束后发现有少量黑色固体及白色固体存在;③将上述冷却后的反应混合物用水稀释得蓝色溶液,白色固体消失,但仍有黑色固体存在;④向稀释后的所得溶液中加入过量碱式碳酸铜[Cu2(OH)2CO3],充分搅拌;⑤过滤,弃去不溶物;⑥将滤液转回洗净的蒸发皿内,用沸水浴缓缓加热蒸发,浓缩至表面有晶膜析出时为止,取下蒸发皿使溶液冷却,析出蓝色晶体。
(1)步骤⑤中要用到的玻璃仪器有_________________________________________________。
(2)步骤④中发生反应的离子方程式是____________________________________________。
(3)简述步骤③的具体操作方法:________________________________________________。
(4)下列叙述错误的是_____________
A.将铜片灼烧,可以减少浓硫酸的消耗量
B.用浓硫酸溶解灼烧后的铜片时,应在通风橱中进行
C.步骤②中得到的黑色固体是CuO
D.步骤②中得到的白色固体是CuSO4
E.步骤⑥中为加快蒸发速度,也可用酒精灯直接给蒸发皿加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com