

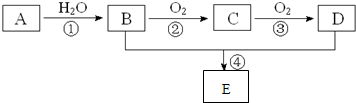
分析 除去KCl溶液中的少量MgCl2和MgSO4,可看成把Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2可加入所选试剂中的K2CO3而除去;最后通过滴加盐酸可把过量的K2CO3及反应生成的KOH同时反应掉而生成KCl,将KCl溶液进行蒸发操作可得到KCl,由以上分析可知A为Ba(OH)2、B为K2CO3、C为HCl,以此解答该题.
解答 解:除去KCl溶液中的少量MgCl2和MgSO4,可看成把Mg2+、SO42-沉淀而除去,因此选择所提供试剂中的Ba(OH)2可同时沉淀掉Mg2+、SO42-离子;反应生成的BaCl2和过量的Ba(OH)2可加入所选试剂中的K2CO3而除去;最后通过滴加盐酸可把过量的K2CO3及反应生成的KOH同时反应掉而生成KCl,将KCl溶液进行蒸发操作可得到KCl,由以上分析可知A为Ba(OH)2、B为K2CO3、C为HCl,
(1)由以上分析可知A为Ba(OH)2、B为K2CO3、C为HCl,故答案为:Ba(OH)2;K2CO3;HCl;
(2)加入Ba(OH)2,可生成氢氧化镁和硫酸钡沉淀,反应的化学方程式为MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓ MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓,
故答案为:为了除尽Mg2+和SO42-;MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓; MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓;
(3)加入过量的K2CO3溶液可使滤液中混有的Ba(OH)2完全反应而除去;相关反应的化学方程式有Ba(OH)2+K2CO3═BaCO3↓+2KOH或 BaCl2+K2CO3═BaCO3↓+2KCl,
故答案为:为了除尽过量的Ba2+;
(4)若先加过量C后再过滤,过量的氢氧化钡溶液中钡离子不能除去,将对实验结果产生影响,
故答案为:过量的氢氧化钡溶液中钡离子不能除去;
(5)将KCl溶液制成KCl晶体的蒸发操作过程中,要使用的主要仪器有:坩埚钳、铁架台(带铁圈)、玻璃棒、酒精灯、蒸发皿,
故答案为:蒸发皿;酒精灯;
(6)向容量瓶中转移液体时,要用玻璃棒来引流,配制一定体积的溶液要选择一定体积的容量瓶,
故答案为:未用玻璃棒引流,未采用250mL容量瓶.
点评 本题考查了混合物的分离提纯、离子性质、沉淀顺序和试剂选择、主要是实验基本操作和溶液配制,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
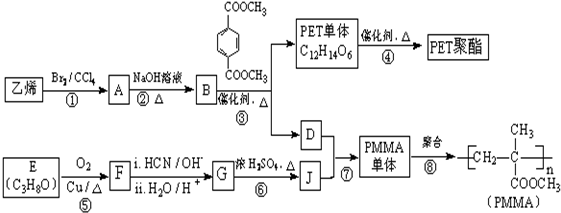
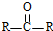 $→_{H_{2}O/H+}^{i.HCN/OH-}$
$→_{H_{2}O/H+}^{i.HCN/OH-}$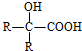 (R、R′代表烃基)
(R、R′代表烃基)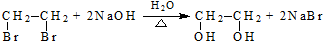
 .
.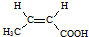 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lNA | B. | 2NA | C. | 3NA | D. | 0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
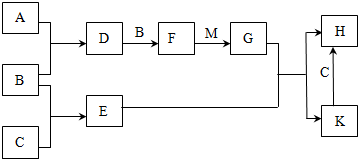
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验方案 | 实验现象 |
| 1.用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 2.向新制的H2S饱和溶液中滴加新制的氯水 3.钠与滴有酚酞试液的冷水反应 4.镁带与2mol/L的盐酸反应 5.铝条与2mol/L的盐酸反应 6.向AlCl3溶液中滴加NaOH溶液至过量 | A.浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红色 B.产生大量气体,气体可燃,溶液变浅红色 C.反应不十分强烈,产生的气体可燃 D.剧烈反应,产生的气体可燃 E.生成白色絮状沉淀,继而沉淀消失 F.生成淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是212 | B. | 中子数是130 | C. | 电子数是194 | D. | 质量数是82 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com