
【题目】在某一容积为5 L的密闭容器中,进行如下化学反应: CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T /℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =______________。
(2)该反应为____________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________________。
a 容器中压强不变 b 混合气体中 c(CO)不变
c υ正(H2)=υ逆(H2O) d c (CO2)=c (CO)
(4)830℃下,若物质的浓度关系是c (CO2)·c (H2) > c (CO)·c (H2O),则此时正反应速率与逆反应速率的关系是____________。
a υ正 > υ逆 b υ正 = υ逆 c υ正 < υ逆 d 无法判断
(5)若开始时向该容器中加入CO2和H2各0.1 mol,在830℃和催化剂存在的条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)=_______________。
【答案】![]() 吸热 bc a 0.01 mol/L
吸热 bc a 0.01 mol/L
【解析】
(1)根据化学平衡常数的概念来书写;
(2)根据温度对化学平衡、化学平衡常数的影响来回答;
(3)化学平衡状态的标志:正逆反应速率相等;
(4)根据800℃时,Qc=![]() 与K比较判断反应方向;
与K比较判断反应方向;
(5)若开始时向该容器中加入CO2和H2各0.1 mol,则CO2和H2的浓度均为0.02 mol/L,在830℃和催化剂存在的条件下,反应达到平衡时,设水蒸气的物质的量浓度c(H2O)=cmol/L,则有CO2(g)+H2(g)![]() CO(g)+H2O(g)可知CO2和H2的平衡浓度均为(0.02-c)mol/L,CO的平衡浓度为cmol/L,结合平衡常数K=1计算。
CO(g)+H2O(g)可知CO2和H2的平衡浓度均为(0.02-c)mol/L,CO的平衡浓度为cmol/L,结合平衡常数K=1计算。
(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以为K=![]() ;
;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,化学平衡常数增大,说明化学平衡正向移动,因此正反应方向吸热;
(3)a.反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b.化学平衡时,各组分的浓度不随时间的改变而改变,故b正确;
c.化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故c正确;
d.c(CO2)=c(CO)时,不能表明正逆反应速率相等,不一定达到了平衡状态,故d错误;
故答案为bc;
(4)830℃下,若物质的浓度关系是c (CO2)·c (H2) > c (CO)·c (H2O),则Qc=![]() <1,此时平衡正向移动,即υ正 > υ逆,故答案为a;
<1,此时平衡正向移动,即υ正 > υ逆,故答案为a;
(5)若开始时向该容器中加入CO2和H2各0.1 mol,则CO2和H2的浓度均为0.02 mol/L,在830℃和催化剂存在的条件下,反应达到平衡时,设水蒸气的物质的量浓度c(H2O)=cmol/L,则有CO2(g)+H2(g)![]() CO(g)+H2O(g)可知CO2和H2的平衡浓度均为(0.02-c)mol/L,CO的平衡浓度为cmol/L,由平衡常数K=
CO(g)+H2O(g)可知CO2和H2的平衡浓度均为(0.02-c)mol/L,CO的平衡浓度为cmol/L,由平衡常数K=![]() =
=![]() =1,解得:c=0.01,即反应达到平衡时,水蒸气的物质的量浓度c(H2O)为0.01 mol/L。
=1,解得:c=0.01,即反应达到平衡时,水蒸气的物质的量浓度c(H2O)为0.01 mol/L。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充有10molCO与20molH2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。下列说法正确的是( )
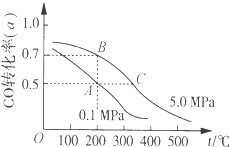
A.若A、B两点表示在某时刻达到的平衡状态,则A、B两点时容器内总气体的物质的量,n(A):n(B)=4:5
B.若A、C两点都表示已达到的平衡状态,则从反应开始至到达平衡状态所需的时间tA>tC
C.设B、C两点的平衡常数分别为KB、KC,则KB<KC
D.在不改变反应物用量的情况下,采取降温、减压或将甲醇从混合体系中分离出来均可提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为2 L的两个恒容密闭容器中分别充入1molSiHCl3,维持容器的温度分别为T1℃和T2℃不变,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是
SiH2Cl2(g)+SiCl4(g) ΔH1=a kJ·mol1。反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是
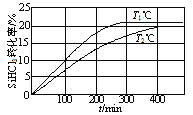
A.T1>T2
B.T1℃时,0~100min反应的平均速率v(SiHCl3)=0.001mol·(L·min)-1
C.T2℃时,反应的平衡常数:K=1/64
D.T2℃时,使用合适的催化剂,可使SiHCl3的平衡转化率与T1℃时相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H-H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据热化学方程式:N2(g) +3H2(g) =2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是_________。
(2)已知下列热化学方程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H=﹣25 kJ·mol-1
②3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H=﹣47 kJ·mol-1
③Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H=﹢19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______________。
(3)氯化铁水解的离子方程式为__________ ,配制氯化铁溶液时滴加少量盐酸的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中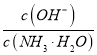 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,三个容积均为2.0 L恒容密闭容器中发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示:
N2(g)+2CO2(g),各容器中起始物质的量浓度与反应温度如下表所示:
容器 | 温度/℃ | 起始物质的量浓度/(mol·L-1) | |||
NO(g) | CO(g) | N2 | CO2 | ||
甲 | T1 | 0.10 | 0.10 | 0 | 0 |
乙 | T2 | 0 | 0 | 0.10 | 0.20 |
丙 | T2 | 0.10 | 0.10 | 0 | 0 |
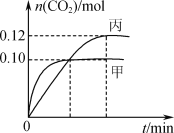
反应过程中甲、丙容器中CO2的物质的量随间变化关系如图所示。下列说法正确的是
A.该反应的正反应为放热反应,平衡常数K(T1)<K(T2)
B.达到平衡时,乙容器中的压强一定大于甲容器的2倍
C.乙容器中反应达到平衡时,N2的转化率大于40%
D.丙容器中反应达到平衡后,再充入0.10 mol NO和0.10 mol CO2,此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com