
分析 前四周期元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍,W原子只能有2个电子层,最外层电子数为6,则W为O元素;X、Y和Z分属不同的周期,结合原子序数大小可知X位于第二周期、Y位于第三周期、Z位于第四周期;W可以与Y组成YW型化合物,则Y的化合价为+2价,故Y为Mg元素;X位于第二周期,其原子序数大于O,则X为F元素;X、Y和Z原子序数之和是W原子序数的5倍,即三元素原子序数之和为40,则Z的原子序数之和为:40-12-9=19,则Z为K元素,据此进行解答.
解答 解:前四周期元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍,W原子只能有2个电子层,最外层电子数为6,则W为O元素;X、Y和Z分属不同的周期,结合原子序数大小可知X位于第二周期、Y位于第三周期、Z位于第四周期;W可以与Y组成YW型化合物,则Y的化合价为+2价,故Y为Mg元素;X位于第二周期,其原子序数大于O,则X为F元素;X、Y和Z原子序数之和是W原子序数的5倍,即三元素原子序数之和为40,则Z的原子序数之和为:40-12-9=19,则Z为K元素,
(1)W为O元素,原子的L层电子排布式为 2s22p4,W3分子O3,其分子中含有的化学键为非极性共价键,
故答案为:2s22p4;非极性共价键;
(2)X为F,其单质为F2,F2与水反应的化学方程式为:2F2+2H2O=4HF+O2,
故答案为:2F2+2H2O=4HF+O2;
(3)X为F元素,其氢化物为HF,HF分子间可形成氢键,大大增加了分子间作用力,导致其沸点较高,
故答案为:HF;HF分子之间有氢键;
(4)Z为K元素,钾盐的焰色反应的火焰呈紫色;许多金属盐都可以发生焰色反应,其原因为:灼烧时电子从基态到激发态,激发态电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长光的形式释放能量,从而出现不同的颜色,
故答案为:紫;激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题有利于提高学生的分析、理解能力及逻辑推理能力.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用100毫升量筒量取8.5毫升水 | |
| B. | 在台式天平的左右盘中各放一纸片,调平后,左盘放药品,右盘放砝码并调整游码,称取一定质量的氢氧化钠固体 | |
| C. | 加热试管前,用抹布将试管外壁擦干,以防试管受热不匀而破裂 | |
| D. | 在看到氢气发生器中稀硫酸与锌粒反应开始产生较多气泡时,即可在气体导出管口点燃氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,等质量的N2和CO气体的原子数均为2NA | |
| B. | 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,2.24 L CCl4含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡溶液反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 氯化铵溶液中加入稀NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | 将少量的氯气通入溴化亚铁溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 碳酸氢钠固体和稀盐酸反应:NaHCO3+H+═Na++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2、H2SO4 | B. | Mg(OH)2、H2SO4 | C. | KOH、HCl | D. | Al(OH)3、H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某溶液与稀盐酸反应产生的气体通入澄清石灰水 | 石灰水变浑浊 | 该溶液中一定含有CO32- |
| B | 常温下,将铁片浸入足量浓硫酸中 | 铁片不溶解 | 常温下,铁与浓硫酸一定没有发生化学反应 |
| C | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加KIO3 |
| D | 向苯酚钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比苯酚强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的摩尔体积约为22.4 mol•L-1 | |
| B. | 标准状况下9gH2O体积约为11.2L | |
| C. | 在100 mL水中溶解5.85 g NaCl,则所得NaCl溶液的物质的量浓度为1 mol•L-1 | |
| D. | 同温同压下,相同体积的任何气体所含物质分子的物质的量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
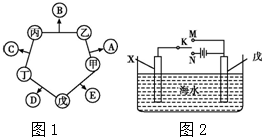 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com