
在密闭容器中进行反应:A(g)+3B(g)⇌2C(g),有关下列图象说法的不正确的是( )

|
| A. | 依据图a可判断正反应为放热反应 |
|
| B. | 在图b中,虚线可表示使用了催化剂 |
|
| C. | 若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动 |
|
| D. | 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
| 化学平衡建立的过程;化学平衡的影响因素. | |
| 专题: | 化学平衡专题. |
| 分析: | A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应; B、催化剂改变反应速率,缩短反应达到平衡的时间,不能改变化学平衡; C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率; D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应. |
| 解答: | 解:A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应,正向是放热反应,可以判断反应热量变化,故A正确; B、催化剂改变反应速率,缩短反应达到平衡的时间,不能改变化学平衡,图象符合改变条件的变化,故B正确; C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率,图象符合反应速率的变化,故C正确; D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应△H<0,故D错误; 故选D. |
| 点评: | 本题考查化学平衡的建立和影响因素的分析判断,图象分析判断是解题关键,题目难度中等. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
氢氧化铁胶体的制备步骤如下:
(1)用烧杯取少量蒸馏水,放在酒精灯上加热至沸腾;
(2)向烧杯中逐滴加入饱和FeCl3溶液;
(3)继续煮沸至液体是透明的红褐色,即得Fe(OH)3胶体.
问题:①写出制备Fe(OH)3胶体的化学方程式②如何确定你制备的胶体是否成功?
③若向Fe(OH)3胶体中滴加(NH4)2SO4溶液可能会出现的现象:,原因:胶
④某同学在活动过程中,边滴加溶液边用玻璃棒搅拌,结果没有制备出胶体,请你帮他分析其中的原因:.
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是( )
A.CO2原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
C.CO2原子晶体和CO2分子晶体具有相同的物理性质
D.在CO2原子晶体中,每一个碳原子周围结合四个氧原子,每个氧原子跟两个碳原子相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属的冶炼,叙述错误的是( )
|
| A. | 活泼金属钠用电解法冶炼 | B. | 用火法或湿法均可制备铜 |
|
| C. | 金属镁只能用热还原法制备 | D. | 铁的冶炼可以用铝热法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中一定能判断某化学平衡发生移动的是( )
|
| A. | 混合物中各组分的浓度发生改变 |
|
| B. | 正、逆反应速率发生改变 |
|
| C. | 反应物的转化率发生改变 |
|
| D. | 混合体系的压强发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)⇌2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化如图所示.下列说法中正确是( )
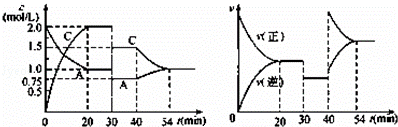
|
| A. | 30 min~40 min间该反应使用了催化剂 |
|
| B. | 反应方程式中的x=1,正反应为吸热反应 |
|
| C. | 30~40min改变的条件是将容器的体积扩大至原来的2倍 |
|
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K1=K2>K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
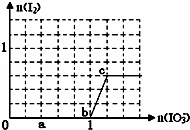
A.0~b间反应:3HSO3﹣+IO3﹣=3SO42﹣+I﹣+3H+
B.a点时消耗NaHSO3的物质的量为1.2 mol
C.b~c间反应:I2仅是氧化产物
D.c点之后碘的物质的量不变是因为还原剂消耗完全
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)⇌2Z(g) 一定达到化学平衡状态的是( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y.
|
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:

(1)滴定终点时的现象为锥形瓶中的溶液
由_____________________________________________;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
________________________________________________;
(3)该小组在步骤①中的错误是________________________,由此造成的测定结果________(填“偏高”或“偏低”或“无影响”);
(4)步骤②缺少的操作是____________________________;
(5)如上图是某次滴定时的滴定管中的液面,其读数为___mL;
(6)根据下列数据:
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
请计算待测烧碱溶液的物质的量浓度。(请写出解答过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com