
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
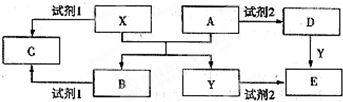
 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
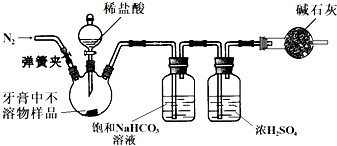
一位同学使用①冷开水 ②碘酒 ③熟石灰 ④淀粉 ⑤肥皂水 ⑥食醋 ⑦红墨水 ⑧铝合金罐 ⑨废干电池(锌筒中装有碳粉、MnO2、NH4Cl、淀粉等糊状物) ⑩食盐纯碱为实验试剂,进行家庭小实验:
(1)用给定的试剂,不能进行的实验是(不考虑电解) (填序号)。
a.制NaOH溶液
b.制备纯净氯气,并实验它的漂白作用
c.实验硬水和肥皂的作用
d.制二氧化碳
e.制硬脂酸
f.进行淀粉水解实验,并检验水解产物
(2)该同学为制备氨气,先从废干电池中制备氯化铵,为此,他准备把废干电池中的糊状物溶于水,过滤,除去不溶物,再蒸发、灼烧滤液,以制得干燥的氯化铵晶体。他的设想 (填“合理”或“不合理”),理由是 。
(3)该同学拟进行除去淀粉溶液中的食盐的实验。他把一个鸡蛋泡在食醋里,待蛋壳溶去,在膜上打一小洞,倒出蛋清、蛋黄,洗净蛋膜,再装入食盐的淀粉溶液扎好袋口。做好这些准备工作后,他即将进行的实验操作名称是 (填“萃取”“盐析”“渗析”“过滤”或“分液”等)。要保证全部除去淀粉溶液里的食盐,实验中必须 ,食醋溶去蛋壳时发生反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源:2012届山东省莱州一中高三第二次质量检测化学试卷 题型:填空题
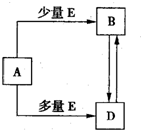
(15分)Ⅰ某化学过程的示意图如图所示。在装置工作过程中,甲池的总反应式为: 。
。
试回答下列问题:
(1)甲池溶液中的 移向 (填“a”或“b”)电极,
移向 (填“a”或“b”)电极,
乙池溶液中的 移向 (填“ A”或“B”)电极;
移向 (填“ A”或“B”)电极;
(2)电极a上发生的电极反应式为 ; (3)乙池中发生反应的离子方程式为 ;
(3)乙池中发生反应的离子方程式为 ;
(4)当电极A处得到0.71g产物时,甲池中理论上消耗
 (标准状况下)。如何检验A处的产物 。
(标准状况下)。如何检验A处的产物 。
Ⅱ某研究性学习小组对铝热反应实验展开研究。现行高中化学教材对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知, 熔点、沸点数据如下:
熔点、沸点数据如下:
| 物质 | Al |  |  | 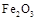 |
| 熔点/℃ | 660 | 2054 | 153 | 14 62 62 |
| 沸点/℃ | 2467 | 2980 | 2 750 750 | - |
 。
。 试剂中最适宜的试剂是
试剂中最适宜的试剂是 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com